
ЛЕНВИМА® (ленватиниб) и эверолимус
Препарат Ленвима® показан к применению в комбинации с эверолимусом у взрослых пациентов с распространенным почечно-клеточным раком, после одного предшествующего курса таргетной терапии ингибиторами рецепторов фактора роста эндотелия сосудов
Механизм действия
Помимо анти-VEGF-активности, комбинация ЛЕНВИМА® + эверолимус обеспечивает тройное ингибирование1.


ДЛЯ ПОЛУЧЕНИЯ БОЛЕЕ ПОДРОБНОЙ ИНФОРМАЦИИ О ПРЕПАРАТЕ ЛЕНВИМА®
ОЗНАКОМЬТЕСЬ С НАШИМИ ПОСЛЕДНИМИ НОВОСТЯМИ И РЕСУРСАМИ
Эффективность
Эффективность комбинации препарата ЛЕНВИМА® и эверолимус изучалась в исследовании 205 — многоцентровом рандомизированном исследовании фазы 2 9, 10.
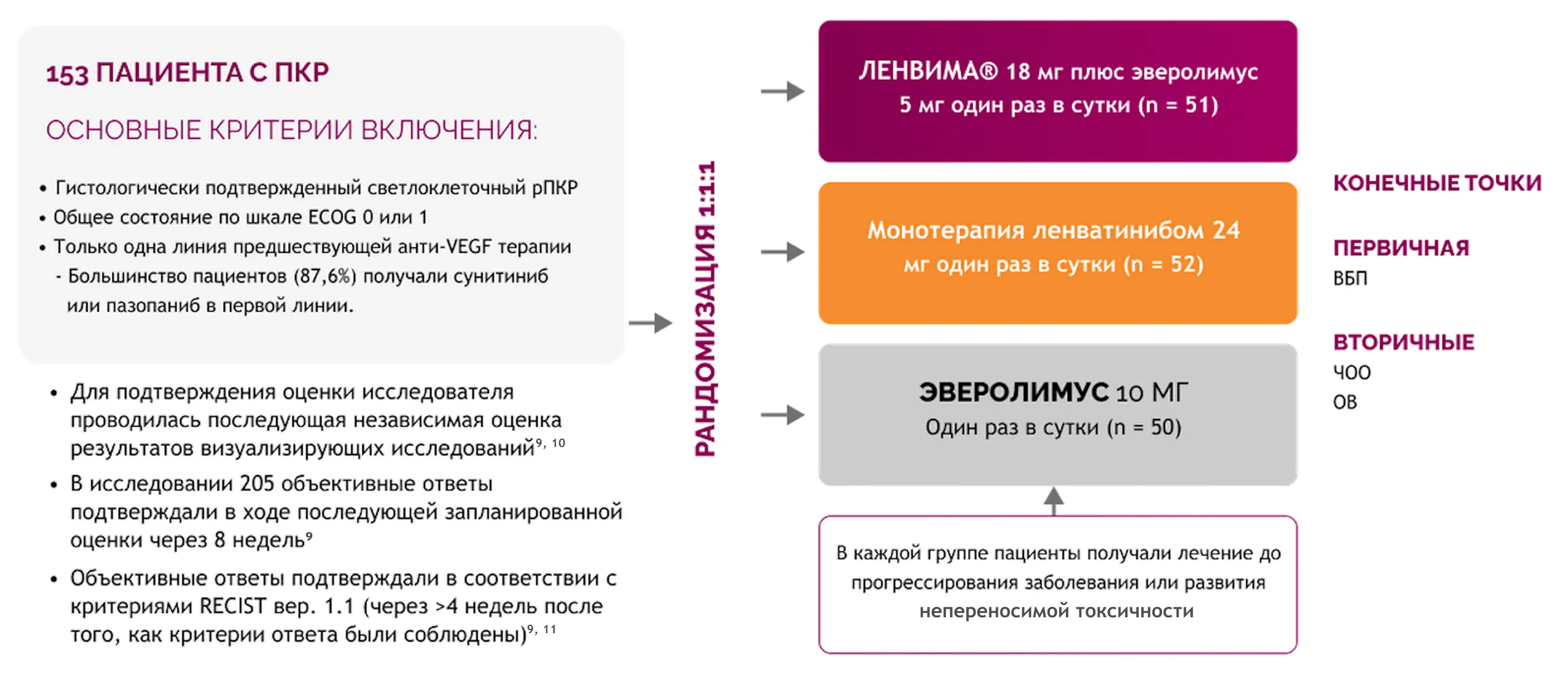
Монотерапия ленватинибом не одобрена для лечения распространенного ПКР.
Доказанная эффективность: медиана ВБП составила 14,6 месяца при применении режима ЛЕНВИМА® + эверолимус по сравнению с 5,5 месяца при применении только эверолимуса9.
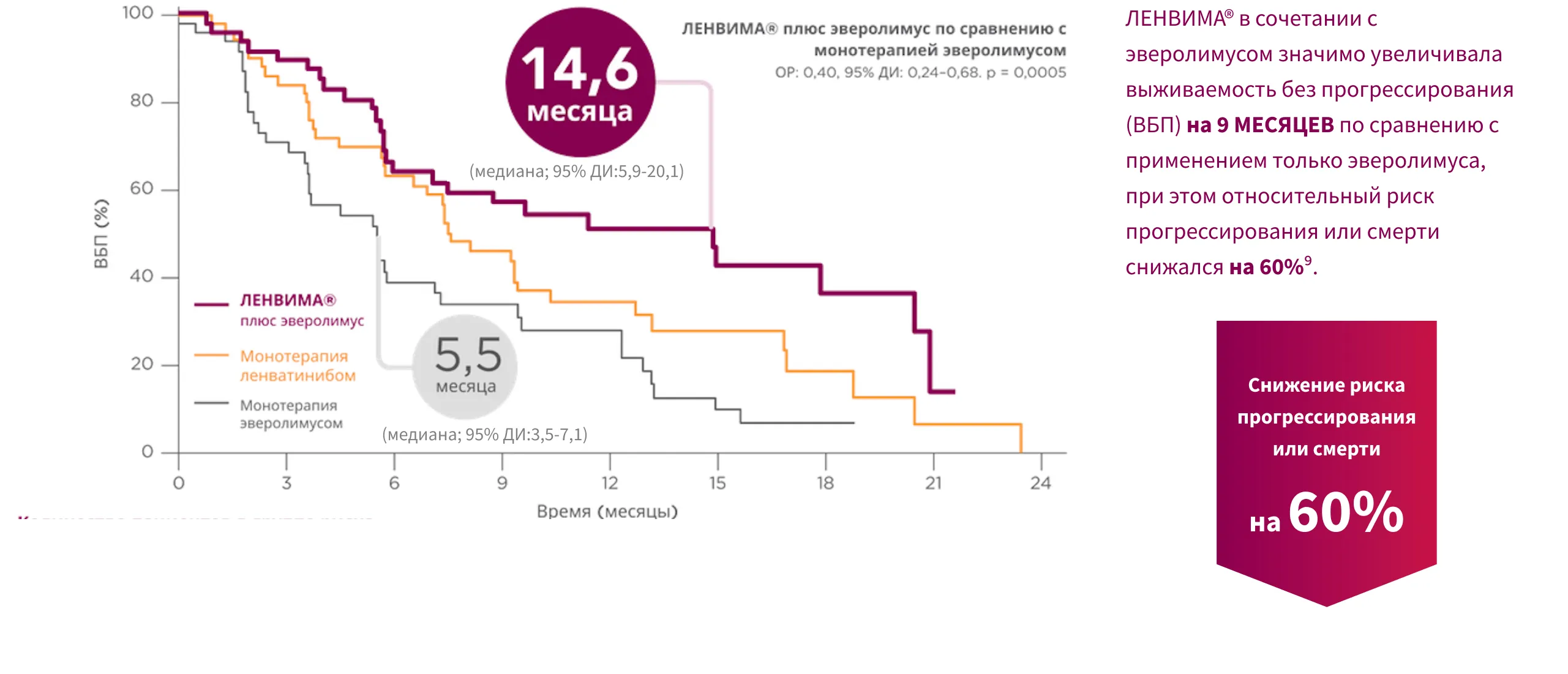
Монотерапия ленватинибом не одобрена для лечения распространенного ПКР.
В обновленном апостериорном анализе* медиана общей выживаемости (ОВ) превышала 2 года при применении препарата ЛЕНВИМА® в сочетании с эверолимусом7, 10.
Медиана ОВ составила 25,5 месяца при применении режима
ЛЕНВИМА® + эверолимус
по сравнению с 15,4 месяца при применении только эверолимуса9.
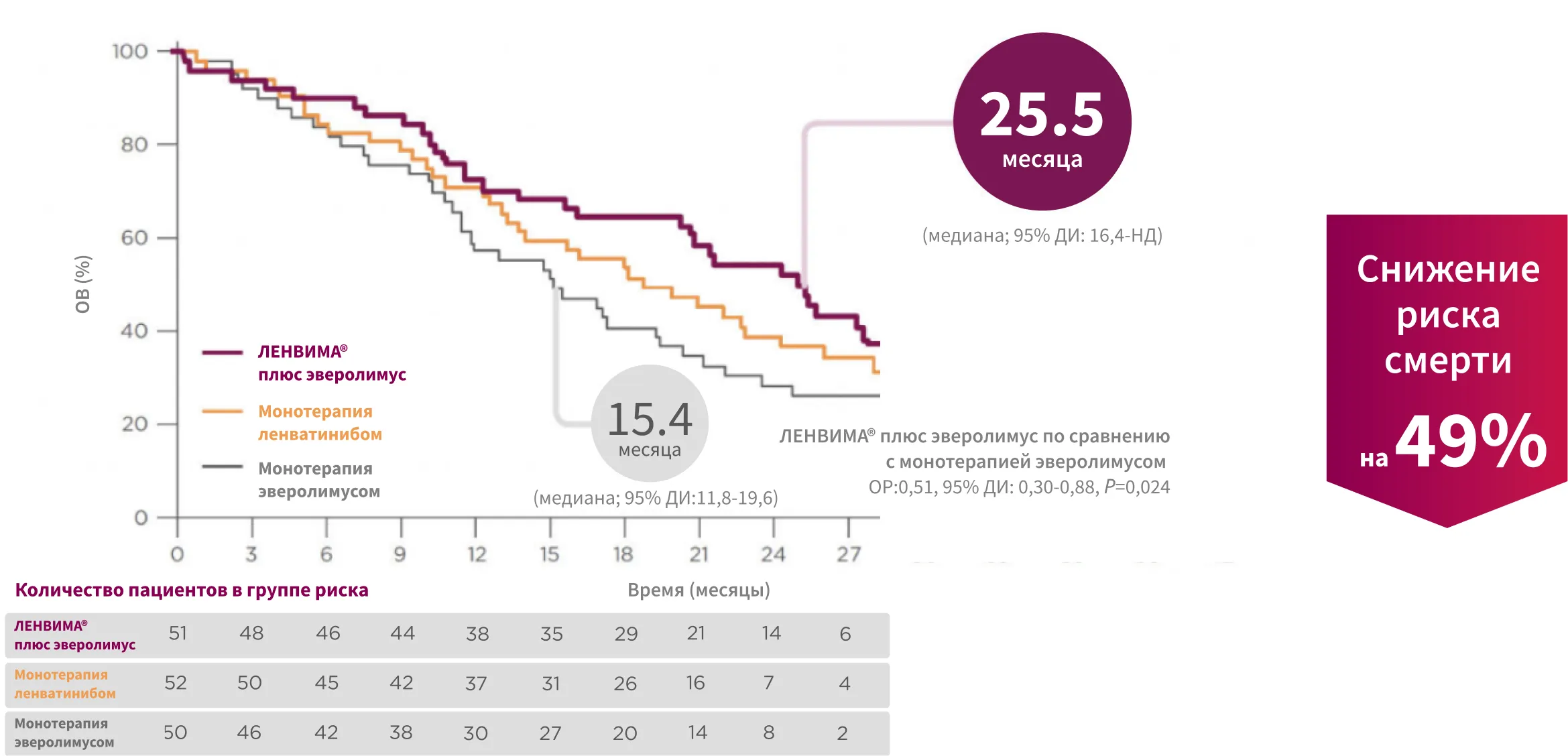
* Обновленный анализ, июль 2015 г. Заранее запланированный анализ ОВ был проведен с использованием данных на дату окончания сбора данных в декабре 2014 года.
Монотерапия ленватинибом не одобрена для лечения распространенного ПКР. Это исследование не обладало достаточной мощностью для анализа ОВ.
Данный анализ является апостериорным, и его результаты следует интерпретировать с осторожностью.
Режим ЛЕНВИМА® + эверолимус показывает высокую эффективность: в 7 раз больше пациентов достигли ответа на лечение по сравнению
с монотерапией эверолимусом7.
Частота объективного ответа (ЧОО) составила 43%* при применении режима
ЛЕНВИМА®
+ эверолимус и 6% при применении только эверолимуса9.
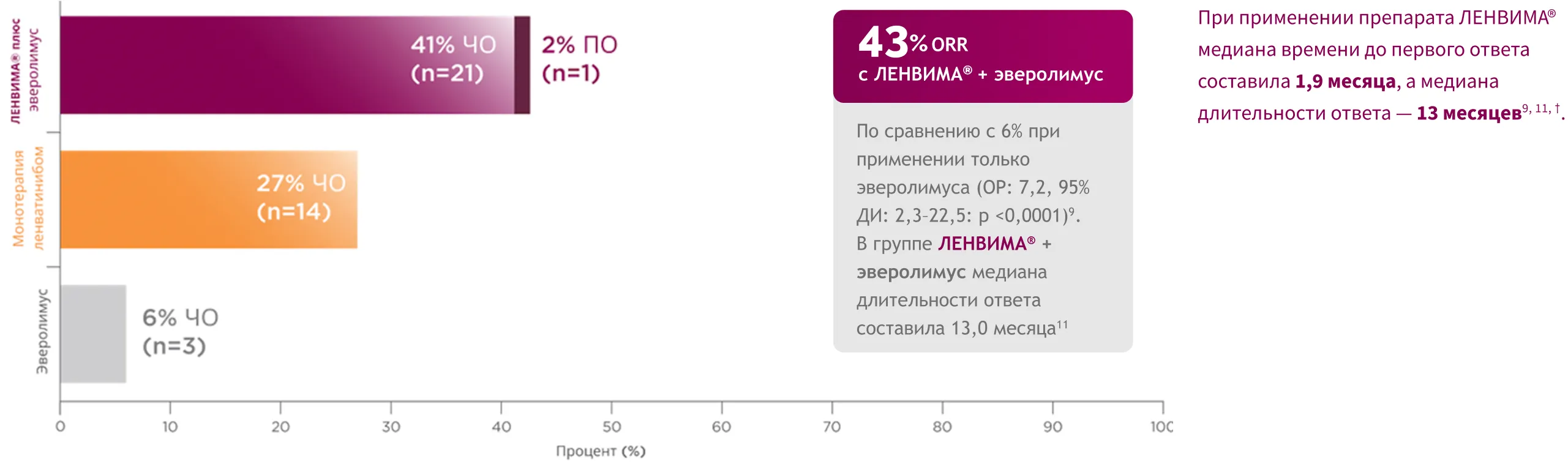
* ЧОО определялась как сумма полных ответов (ПО) и частичных ответов (ЧО). Оценка опухоли была основана на критериях RECIST вер. 1.1 и подтверждена при независимом радиологическом обзоре9, 10.
† Время до первого ответа и длительность ответа при применении эверолимуса не включены из-за ограниченного количества пациентов с объективным ответом.
[Ограничение ответственности] Монотерапия ленватинибом не зарегистрирована для лечения распространенного ПКР.
Режим ЛЕНВИМА® + эверолимус рекомендован Европейским обществом медицинской онкологии (ESMO)* и Национальным институтом охраны здоровья и совершенствования медицинской помощи (NICE) в качестве варианта лечения после одной линии предшествующей терапии ИТК7, 12.
ESMO
Оценка по шкале клинических преимуществ, равная 4, указывает на существенный полезный эффект при применении в качестве терапии второй линии скПКР*, †
NICE
Рекомендуется в качестве варианта лечения рПКР у взрослых пациентов, ранее получивших одну линию анти-VEGF-терапии, если их оценка общего состояния по шкале ECOG составляет 0 или 1
* Оценки ESMO-MCBS для новых методов лечения/показаний, одобренных с 1 января 2016 г. Оценки были рассчитаны рабочей группой ESMO-MCBS и подтверждены Комитетом по рекомендациям ESMO.7
† Препарат ЛЕНВИМА® в комбинации с эверолимусом показан для лечения взрослых пациентов с распространенным почечно-клеточным раком (ПКР) после получения одной линии таргетной терапии, направленной на фактор роста эндотелия сосудов (VEGF)1.
Безопасность и переносимость
Режим ЛЕНВИМА® + эверолимус обладает управляемым профилем безопасности9, *
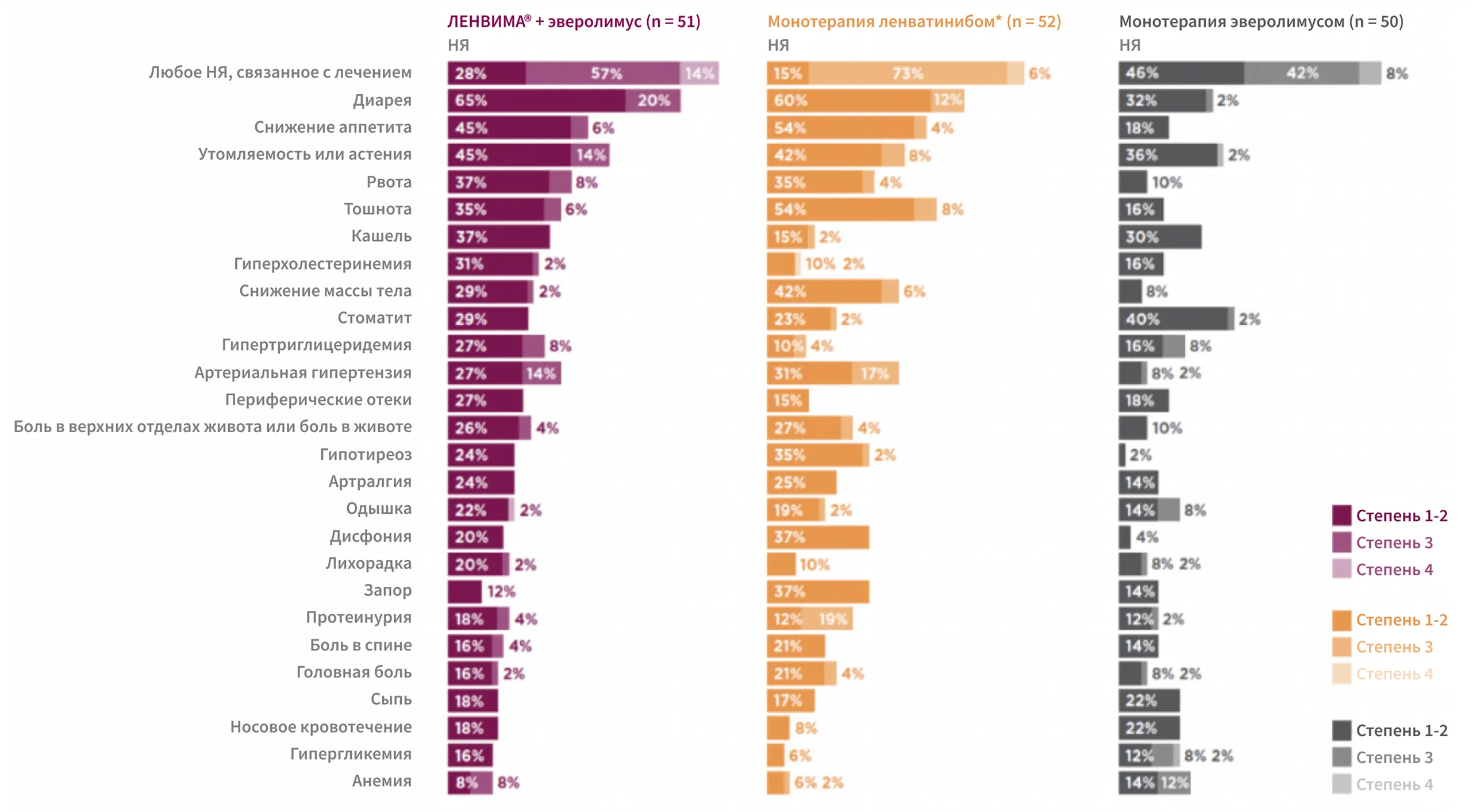
По материалам: Motzer R et al. Lancet Oncol 2015.
* Нежелательные явления (НЯ) любой степени, зарегистрированные у ≥ 20% пациентов в любой группе лечения.
Монотерапия ленватинибом не одобрена для лечения распространенного ПКР.
Наблюдайте за своими пациентами на протяжении всего лечения препаратом ЛЕНВИМА®, чтобы выявлять любые НЯ на раннем этапе15.
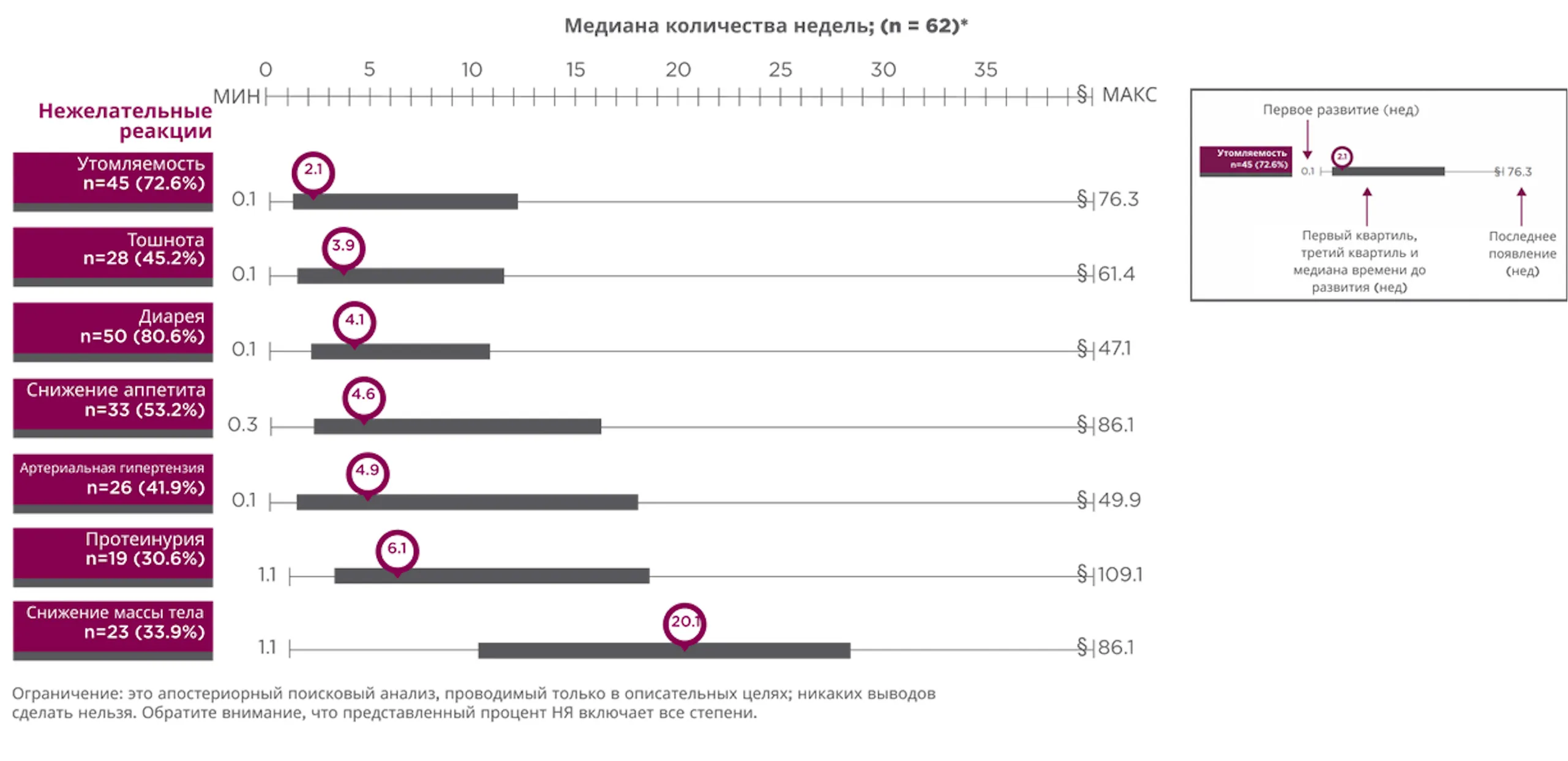
Апостериорный анализ времени до первого развития НЯ при применении препарата ЛЕНВИМА® в комбинации с эверолимусом13
Режим дозирования
Рекомендуемая доза препарата ЛЕНВИМА® 18 мг в комбинации с эверолимусом1, *
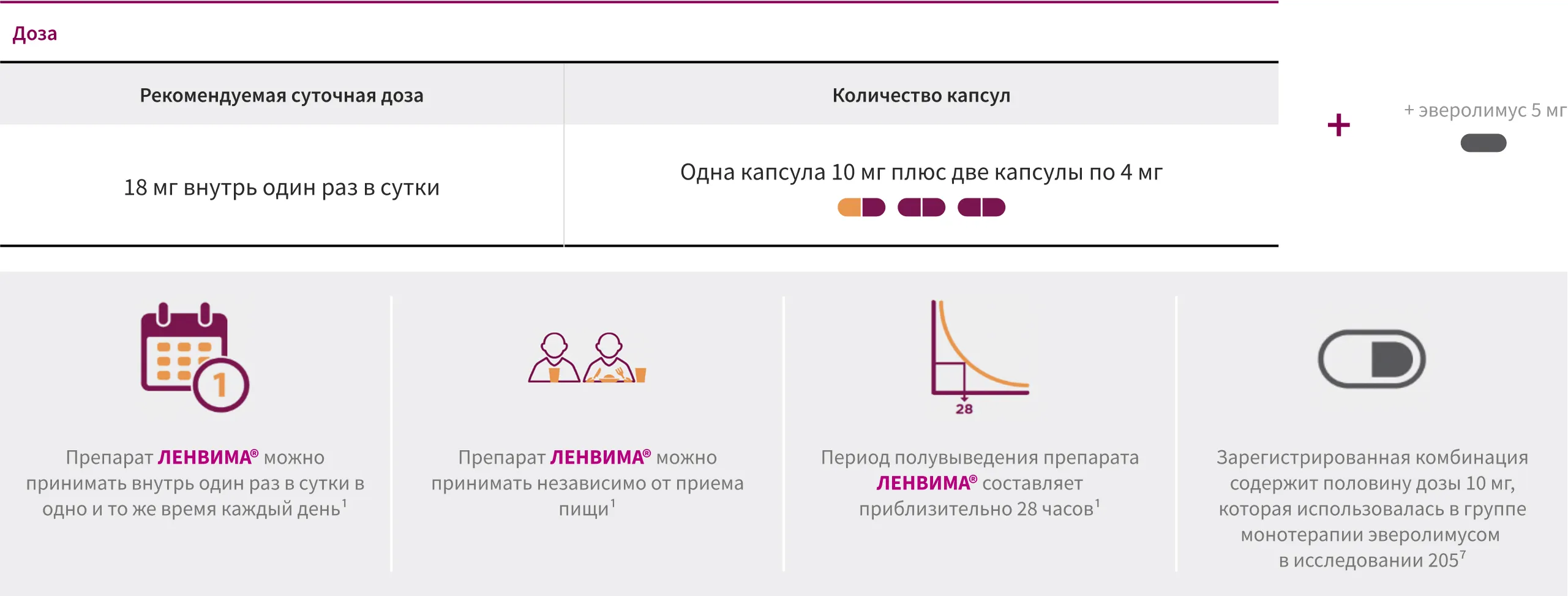

* Изображение капсул не отражает их реальный размер.
Рекомендации коррекции дозы препарата ЛЕНВИМА®
при применении в комбинации с эверолимусом1, †
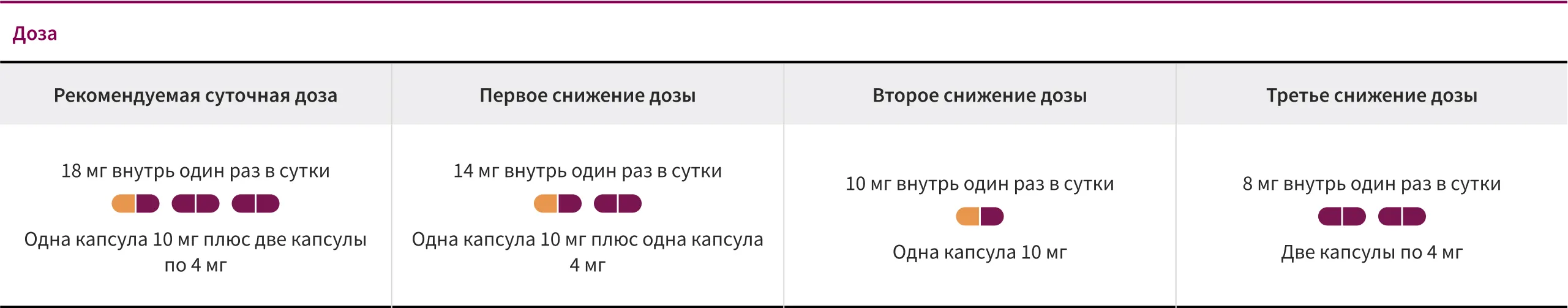

† Легкие и средние нежелательные реакции (т. е. степени 1 или 2), как правило, не требуют прекращения комбинированной терапии, за исключением случаев непереносимости пациентом, несмотря на оптимальную тактику ведения. Тяжелые (т. е. степени 3) или непереносимые НЯ требуют приостановки лечения до улучшения реакции до степени 0–1 или исходного уровня.
Исследование 218: рандомизированное исследование фазы 2 по оценке доз 18 мг и 14 мг/сут
в комбинации с эверолимусом 5 мг14
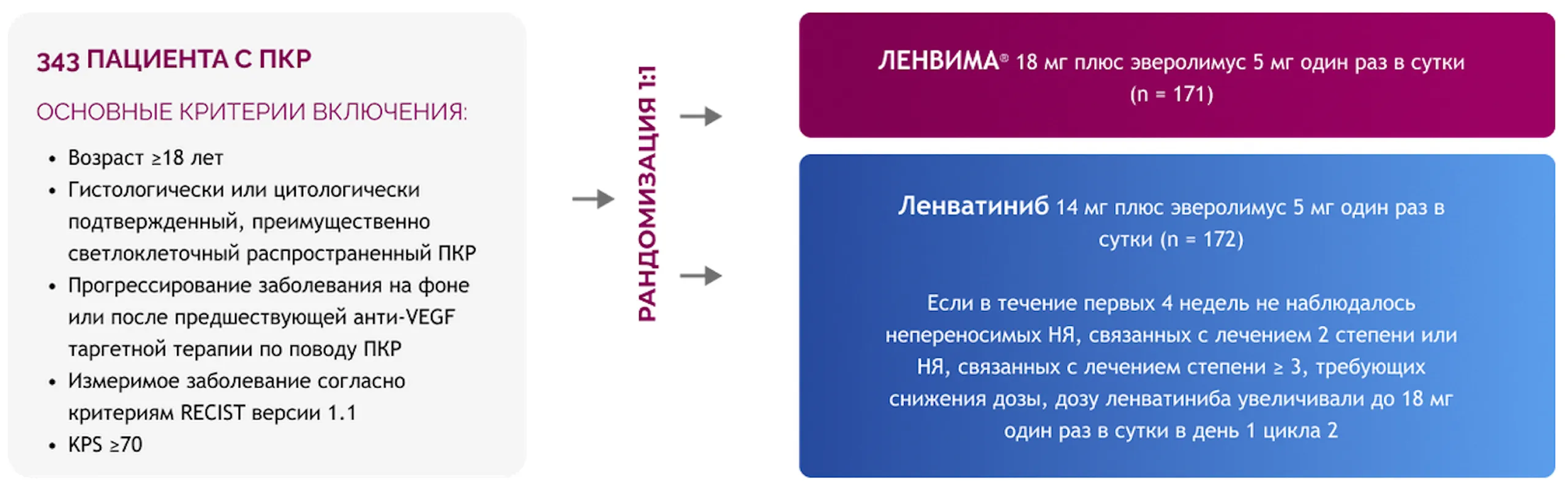
Стратифицировано на основании прогностической группы MSKCC и предшествующей анти-PD-(L)1-терапии.
Первичная конечная точка: ЧОО через 24 недели (оценка неменьшей эффективности), пациенты с непереносимыми НЯ, связанных с лечением, степени 2* или любыми НЯ, связанных с лечением, степени 3, развившимися в течение 24 недель после рандомизации (оценка превосходящей безопасности).
Вторичные конечные точки: общая ЧОО, ВБП, ОВ, безопасность, прекращение лечения из-за НЯ, связанных с лечением, время до терапевтической неудачи лечения из-за токсичности.
* Применимо только к НЯ степени 2, которые пациент и/или врач сочли непереносимыми.
Исследование 218 включало неодобренный режим дозирования (14 мг); он включен в этот раздел для контекста и подтверждения обоснованности зарегистрированной дозировки (18 мг). Статистический анализ всех вторичных конечных точек следует считать описательным.
Исследование 218 подтверждает обоснованность применения комбинации ЛЕНВИМА® + эверолимус
в зарегистрированной начальной дозе ленватиниба 18 мг14.
Первичная конечная точка эффективности (ЧОО на неделе 24): для начальной дозы 14 мг
не была продемонстрирована неменьшая эффективность, поскольку не был достигнут требуемый порог (р ≤ 0,045)14.
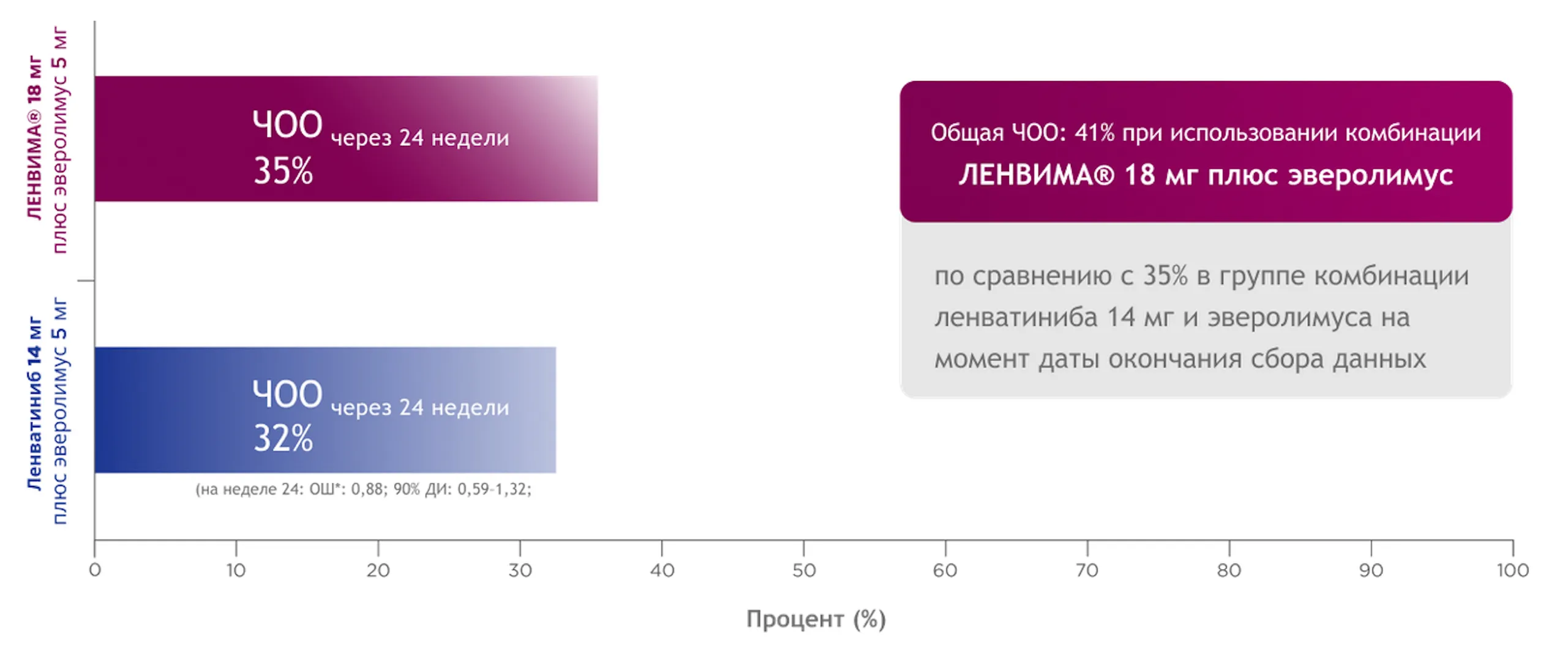
* Применялся критерий Кохрана — Мантеля — Хенселя, использовали стратификацию на основании группы риска MSKCC и предшествующей терапии ингибиторами PD-(L)1 по данным IxRS. Исследование 218 включало неодобренный режим дозирования (14 мг); он включен в этот раздел для контекста и подтверждения обоснованности зарегистрированной дозировки (18 мг).
Cхожий общий профиль безопасности комбинации ЛЕНВИМА® + эверолимус при применении ленватиниба в дозе 18 мг или 14 мг14.
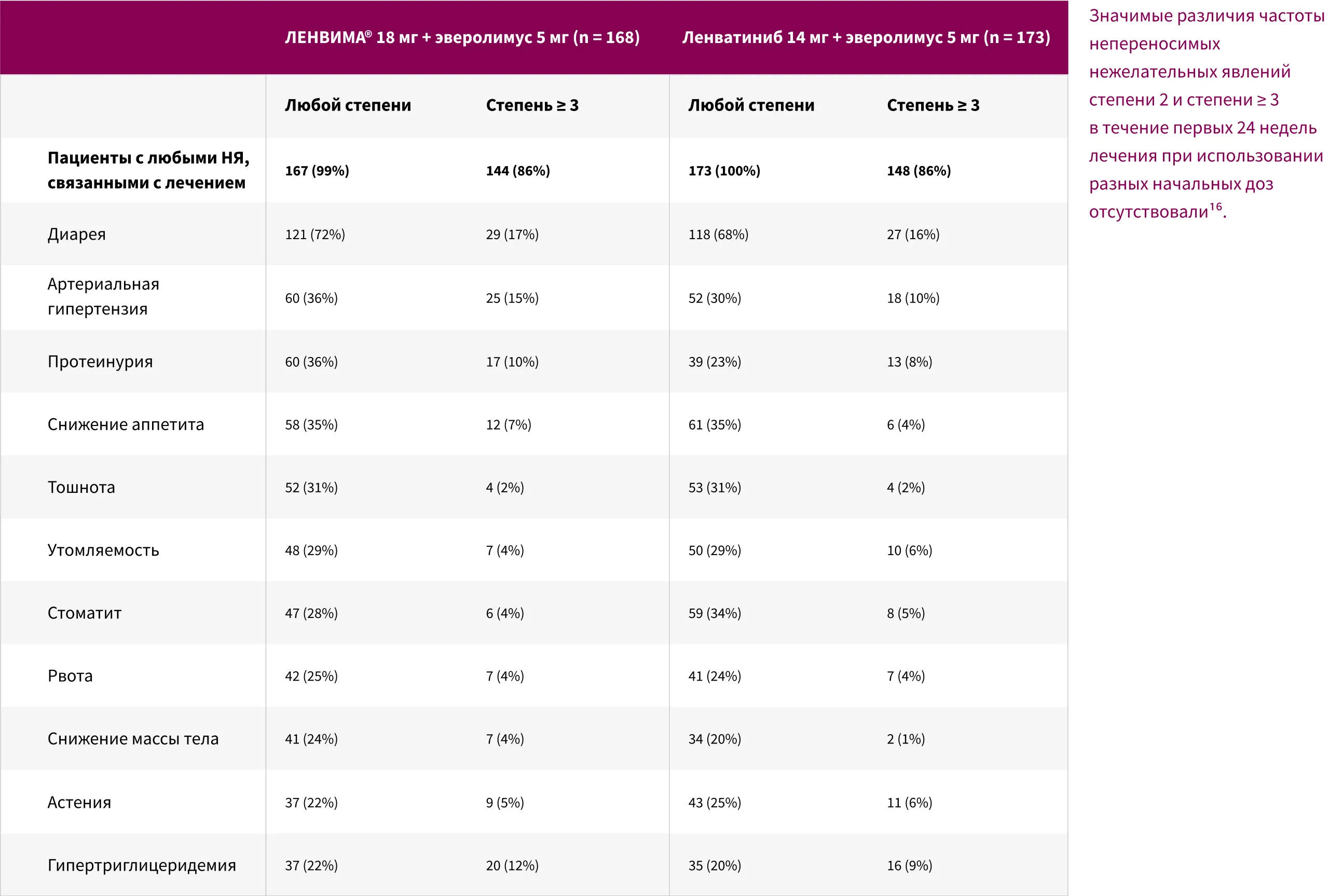
* НЯ, зарегистрированные у ≥ 20% пациентов в любой группе лечения.
Исследование 218 включало неодобренный режим дозирования (14 мг); он включен в этот раздел для контекста и подтверждения обоснованности зарегистрированной дозировки (18 мг).
В исследовании 218 проспективно оценивали ЧОО, ВБП и ОВ при применении препарата ЛЕНВИМА® в комбинации
с эверолимусом после предшествующей иммунотерапии14.
В период после иммунотерапии частота ответа в группе препарата ЛЕНВИМА® 18 мг составила 51,3% по сравнению с 30,2% в группе ленватиниба 14 мг14.
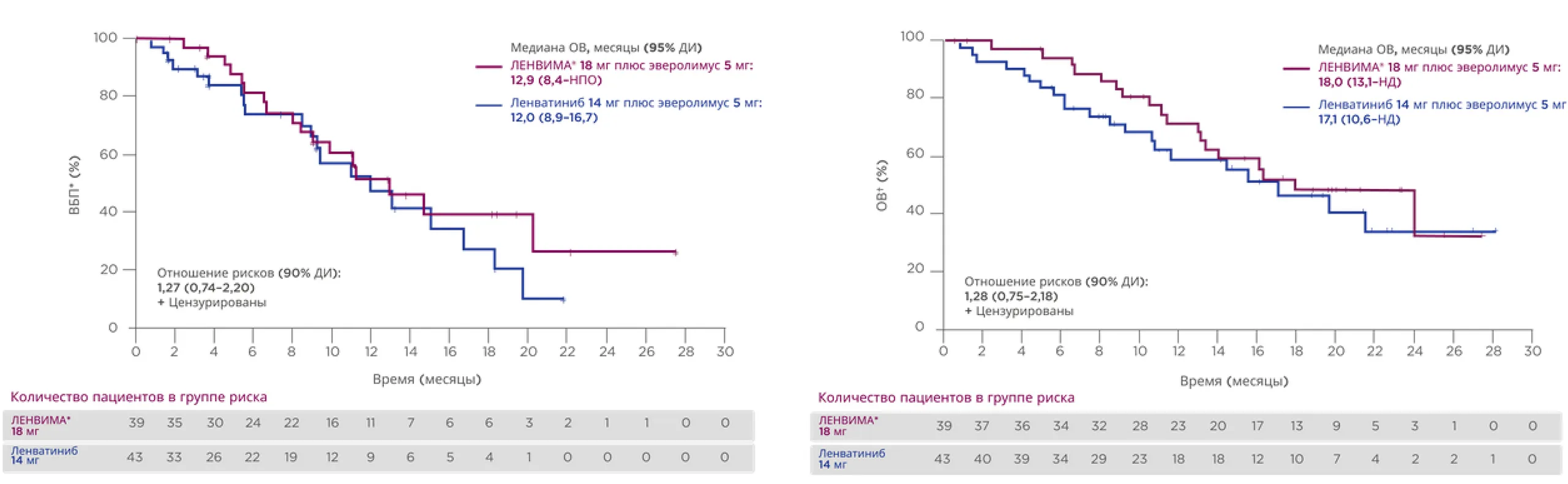
* Анализ ВБП по оценке исследователя по методу Каплана — Мейера.
† У пациентов с предшествующей терапией ИКТ в популяции для анализа данных пациентов, прошедших полный курс лечения согласно протоколу.
(В подгруппу предшествующей терапии ИКТ входят пациенты, ранее получавшие таргетную терапию анти-PD-(L)1-препаратами.)
Исследование 218 включало неодобренный режим дозирования (14 мг); он включен в этот раздел для контекста и подтверждения обоснованности зарегистрированной дозировки (18 мг).
Качество жизни, связанное со здоровьем (HRQOL), и симптомы заболевания у пациентов,
получавших препарат ЛЕНВИМА® 18 мг + эверолимус, были схожи или немного лучше, чем
у пациентов, получавших ленватиниб 14 мг + эверолимус15
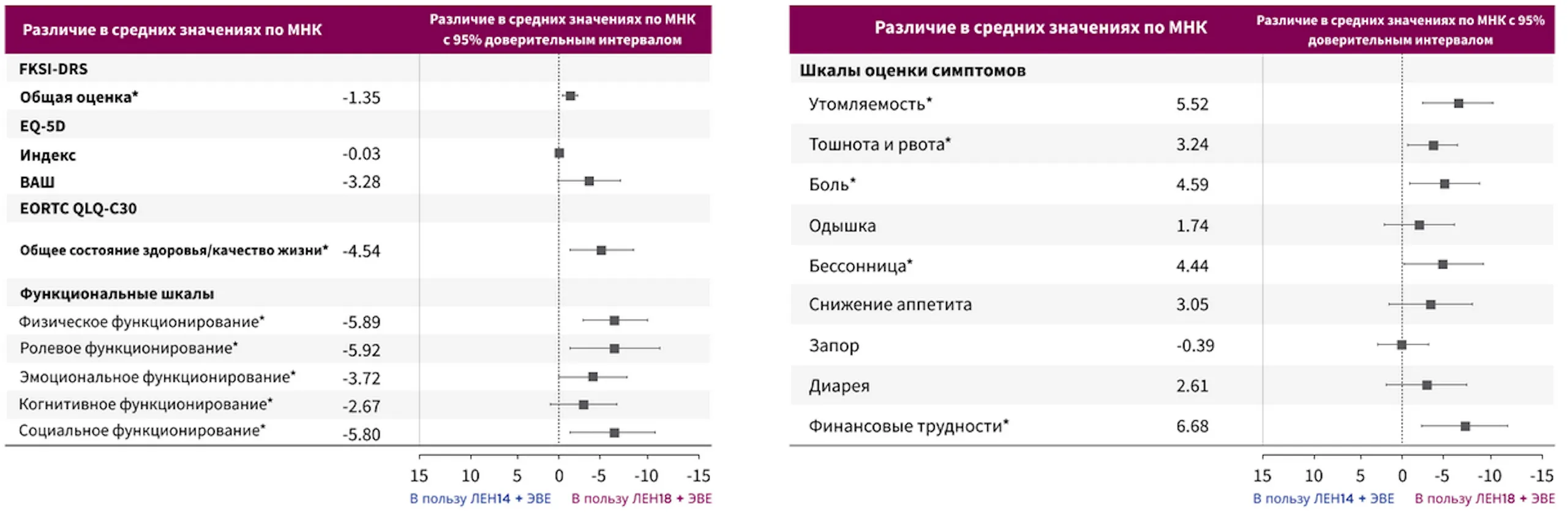
* Шкалы оценки симптомов в опроснике EORTC QLQ-C30 отображены в обратном порядке, поскольку более высокие значения указывают на более выраженные симптомы. Статистический анализ носит описательный характер, и любые различия не являются клинически значимыми.
Исследование 218 включало неодобренный режим дозирования (14 мг); он включен в этот раздел для контекста и подтверждения обоснованности зарегистрированной дозировки (18 мг).
ДЛЯ ПОЛУЧЕНИЯ БОЛЕЕ ПОДРОБНОЙ ИНФОРМАЦИИ О ПРЕПАРАТЕ ЛЕНВИМА®
СВЯЖИТЕСЬ С ПРЕДСТАВИТЕЛЕМ КОМПАНИИ «ЭЙСАЙ»
рПКР — распространенный почечно-клеточный рак; НЯ — нежелательные явления; ДИ — доверительный интервал; CMH — критерий Кохрана — Мантеля — Гензеля; НД не достигнута ПО — полный ответ; ОС — по шкале ECOG, общее состояние по шкале Восточной объединенной онкологической группы; EORTC QLQ-C30 — опросник для оценки качества жизни Европейской организации по изучению и лечению злокачественных новообразований; ESMO — Европейское общество медицинской онкологии; FGF — фактор роста фибробластов; FGFR — рецептор фактора роста фибробластов; FKSI-DRS — функциональная оценка противоопухолевой терапии, индекс симптомов рака почки, симптомы, связанные с заболеванием; ОР — отношение рисков; HRQoL — качество жизни, связанное со здоровьем; ИКТ — ингибитор контрольных точек иммунного ответа; ИО-ИТК — иммуноонкологический ингибитор тирозинкиназы; IxRS — интерактивная система голосового/веб-ответа; KIT — протоонкоген рецепторная тирозинкиназа; KPS — общее состояние по шкале Карновского; МНК — метод наименьших квадратов; мАТ — моноклональное антитело; MCBS — шкала степени клинической пользы; MSKCC — Мемориальный онкологический центр имени Слоуна — Кеттеринга; mTOR — мишень рапамицина у млекопитающих; НПО — не подлежит оценке; NICE — Национальный институт охраны здоровья и совершенствования медицинской помощи; ЧОО — частота объективного ответа; ОВ — общая выживаемость; PD-1 — белок запрограммированной гибели клеток 1; PDGFRα — рецептор тромбоцитарного фактора роста альфа; PD-L1 — лиганд рецептора запрограммированной гибели клеток 1; ВБП — выживаемость без прогрессирования; ЧО — частичный ответ; ПКР — почечно-клеточный рак; RECIST — критерии оценки ответа солидных опухолей на лечение; RET — перестройка при трансфекции; RR — отношение частот; НЯВЛ — нежелательное явление, возникшее во время лечения; ИТК — ингибитор тирозинкиназы; ВАШ — визуальная аналоговая шкала; VEGF — фактор роста эндотелия сосудов; VEGFR — рецептор фактора роста эндотелия сосудов.
-
-
- 1. Общая характеристика лекарственного препарата (ОХЛП) Ленвима® (ленватиниб), капсулы. РУ ЛП-№(001897)-(РГ-RU).
- 2. Общая характеристика лекарственного препарата (ОХЛП) Афинитор (эверолимус) ЛП-№(004943)-(РГ-RU)-250724.
- 3. Stjepanovic N, Capdevila J. Multikinase inhibitors in the treatment of thyroid cancer: specific role of lenvatinib. Biologics. 2014 Apr 10;8:129-39. doi: 10.2147/BTT.S39381. PMID: 24748771; PMCID: PMC3990290.
- 4. Matsui J, et.al., E7080, a novel inhibitor that targets multiple kinases, has potent antitumor activities against stem cell factor producing human small cell lung cancer H146, based on angiogenesis inhibition. Int J Cancer. 2008 Feb 1;122(3):664-71. doi: 10.1002/ijc.23131. PMID: 17943726.
- 5. Yang J, Yan J, Liu B. Targeting VEGF/VEGFR to Modulate Antitumor Immunity. Front Immunol. 2018 May 3;9:978. doi: 10.3389/fimmu.2018.00978. PMID: 29774034; PMCID: PMC5943566.
- 6. Glen, H. Lenvatinib Therapy for the Treatment of Patients with Advanced Renal Cell Carcinoma. Future Oncology2016, 12(19), 2195–2204. https://doi.org/10.2217/fon-2016-0215. Available at: https://www.ema.europa.eu/en/documents/product-information/afinitor-epar-product-information_en.pdf. Accessed February 2023.
- 7. Escudier B, et.al., ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019 May 1;30(5):706-720. doi: 10.1093/annonc/mdz056. PMID: 30788497.
- 8. Houghton PJ. Everolimus. Clin Cancer Res. 2010;16(5):1368-1372. doi:10.1158/1078-0432.CCR-09-1314.
- 9. Motzer RJ, et.al., Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol. 2015 Nov;16(15):1473-1482. doi:10.1016/S1470-2045(15)00290-9. Epub 2015 Oct 22. Erratum in: Lancet Oncol. 2016 Jul;17(7):e270. doi:10.1016/S1470-2045(16)30233-9. Erratum in: Lancet Oncol. 2018 Oct;19(10):e509. doi:10.1016/S1470-2045(18)30672-7. PMID: 26482279.
- 10. Motzer RJ, et.al., Independent assessment of lenvatinib plus everolimus in patients with metastatic renal cell carcinoma. Lancet Oncol. 2016 Jan;17(1):e4-5. doi:10.1016/S1470-2045(15)00543-4. Epub 2015 Dec 23. PMID: 26758760.
- 11. Motzer R. et al. Lancet Oncol. 2015: 16(15): 1473–1482 (supplementary appendix).
- 12. NICE. NICE Guideline [TA498]. 2018. [NOTE: local markets to replace with relevant national guidelines.
- 13. Clinical Study Report for Study E7080-G000-205, Table 1, Overview of Clinical Significant Treatment-Emergent Adverse Event.
- 14. Pal S. et al. Eur Urol. 2022; 82(3): 283–292.
- 15. Bergerot C, et.al., Health-Related Quality of Life Outcomes With Two Different Starting Doses of Lenvatinib in Combination With Everolimus for Previously Treated Renal Cell Carcinoma. Oncologist. 2023 Jan 18;28(1):59-71. doi: 10.1093/oncolo/oyac142. PMID: 35881028; PMCID: PMC9847563.
-
