
ЛЕНВИМА® + пембролизумаб
Препарат Ленвима® показан к применению в комбинации с пембролизумабом в качестве 1-й линии терапии у взрослых пациентов с распространенным почечно-клеточным раком1.
Механизм действия препарата ЛЕНВИМА®2
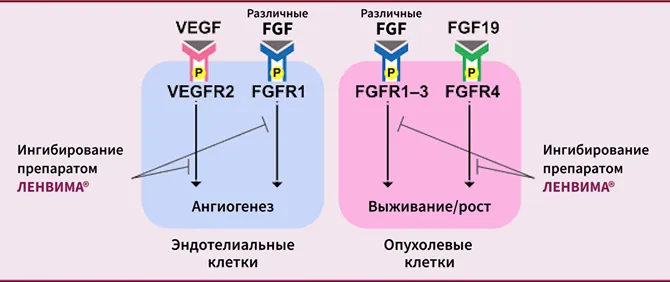
По материалам Kudo M. et al. 20182.
Механизм действия
ЛЕНВИМА® представляет собой ингибитор рецепторов тирозинкиназ (ИТК), который избирательно подавляет киназную активность рецепторов фактора роста эндотелия сосудов (VEGF) — VEGFR1 (FLT1), VEGFR2 (KDR) и VEGFR3 (FLT4), в дополнение к другим ИТК, связанным с проангиогенными и онкогенными путями, включая рецепторы фактора роста фибробластов (FGF) — FGFR1, FGFR2, FGFR3 и FGFR4, рецепторы тромбоцитарного фактора роста (PDGF) PDGFRα, а также KIT и RET1.
Препарат ЛЕНВИМА® в сочетании с моноклональным антителом к PD-1 снижал количество ассоциированных с опухолью макрофагов,
увеличивал число активированных цитотоксических Т-клеток и обладал более высокой противоопухолевой активностью
по сравнению
с применением любого из этих препаратов по отдельности на моделях опухолей сингенных мышей1.
Эффективность
Эффективность комбинации препарата ЛЕНВИМА® с пембролизумабом изучалась в исследовании CLEAR3.
Исследование CLEAR представляет собой открытое многоцентровое рандомизированное исследование с участием 1069
пациентов из всех групп риска согласно критериям Международного консорциума по лечению метастатического ПКР (IMDC) и
Мемориального онкологического центра имени Слоуна — Кеттеринга (MSKCC)3.
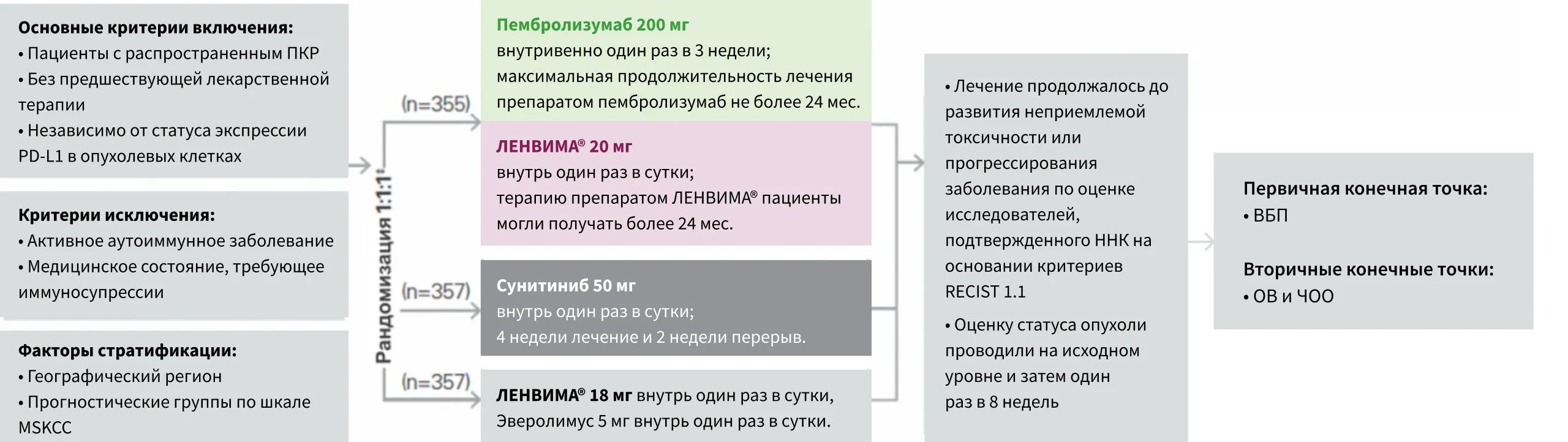
* Северная Америка и Западная Европа или остальные регионы мира.
† Рандомизация была стратифицирована в соответствии с прогностическими группами MSKCC: благоприятный, промежуточный и неблагоприятный прогнозы.
‡ Клинические данные представлены для группы комбинации ЛЕНВИМА® + пембролизумаб и группы сунитиниба. Режим ЛЕНВИМА® + эверолимус
не зарегистрирован для использования в качестве терапии первой линии, данные не представлены.
Применение препаратов ЛЕНВИМА® + пембролизумаб разрешалось после прогрессирования заболевания согласно критериям RECIST 1.1, если пациенты были клинически стабильны и сохранялся клинический эффект по мнению исследователя.
1Л — первая линия; ННК — независимый комитет по оценке; MSKCC — Мемориальный онкологический центр имени Слоуна — Кеттеринга; ЧОО — частота объективного ответа; ОВ — общая выживаемость; PD-L1 — лиганд рецептора запрограммированной клеточной гибели1; ВБП — выживаемость без прогрессирования; ПКР — почечно-клеточный рак; RECIST 1.1 — критерии оценки ответа солидных опухолей версии 1.1.
Режим ЛЕНВИМА® + пембролизумаб более чем в 2 раза увеличивал медиану ВБП
по сравнению
с сунитинибом (23,9 месяца по сравнению с 9,2 месяца)3.
* ВБП была первичной конечной точкой эффективности, основанной на независимой оценке (IRC) согласно критериям RECIST 1.1
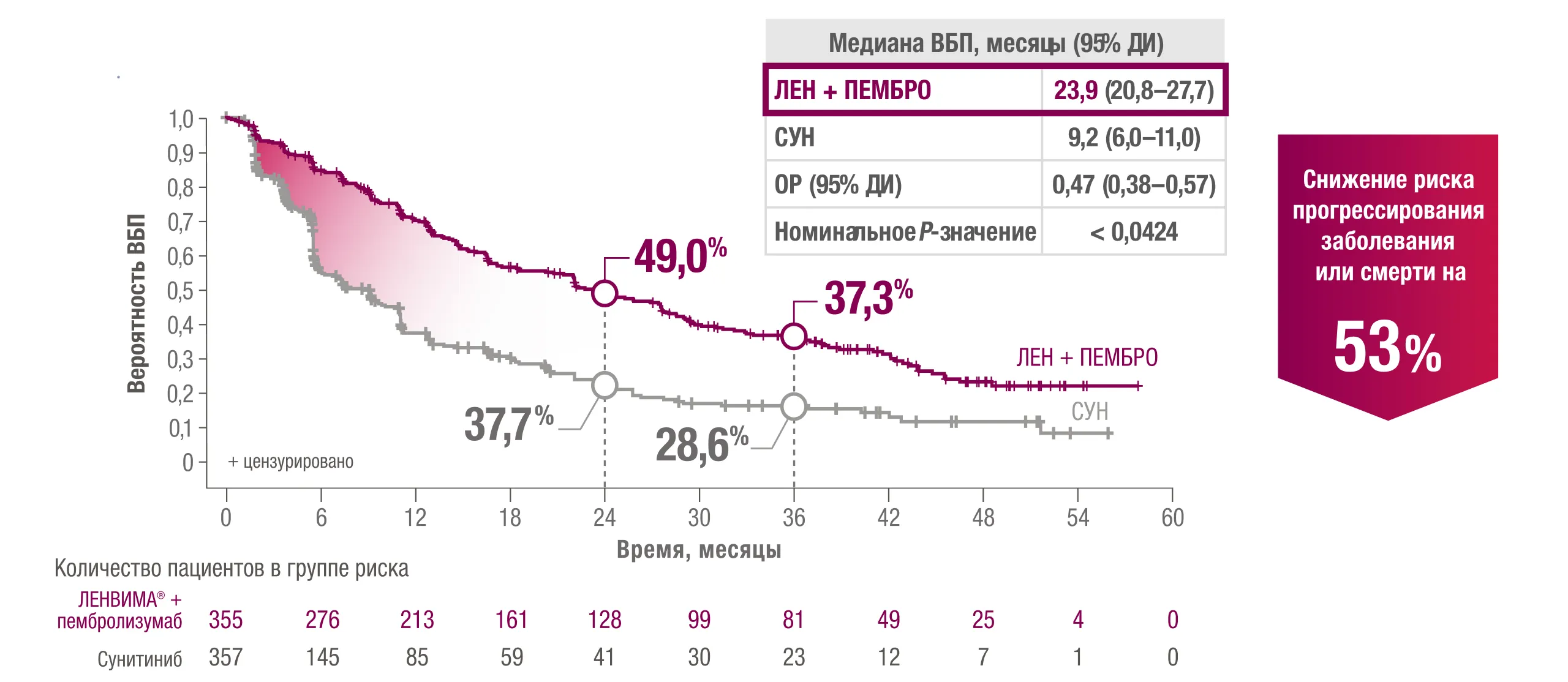
ВБП — выживаемость без прогрессирования.
† Отношение рисков основано на модели пропорциональных рисков Кокса, включавшей группу лечения; для обработки совпадений использовали метод Эфрона.
‡ В платформе IxRS стратификация основана на географическом регионе (регион 1: Западная Европа и Северная Америка, регион 2: остальные страны мира)
и прогностических группах MSKCC (благоприятный, промежуточный и неблагоприятный прогнозы). Двухстороннее значение р определяли с помощью стратифицированного логрангового критерия.
Комбинация ЛЕНВИМА® + пембролизумаб обеспечивала более высокую частоту объективного ответа (ЧОО) по сравнению с сунитинибом3.
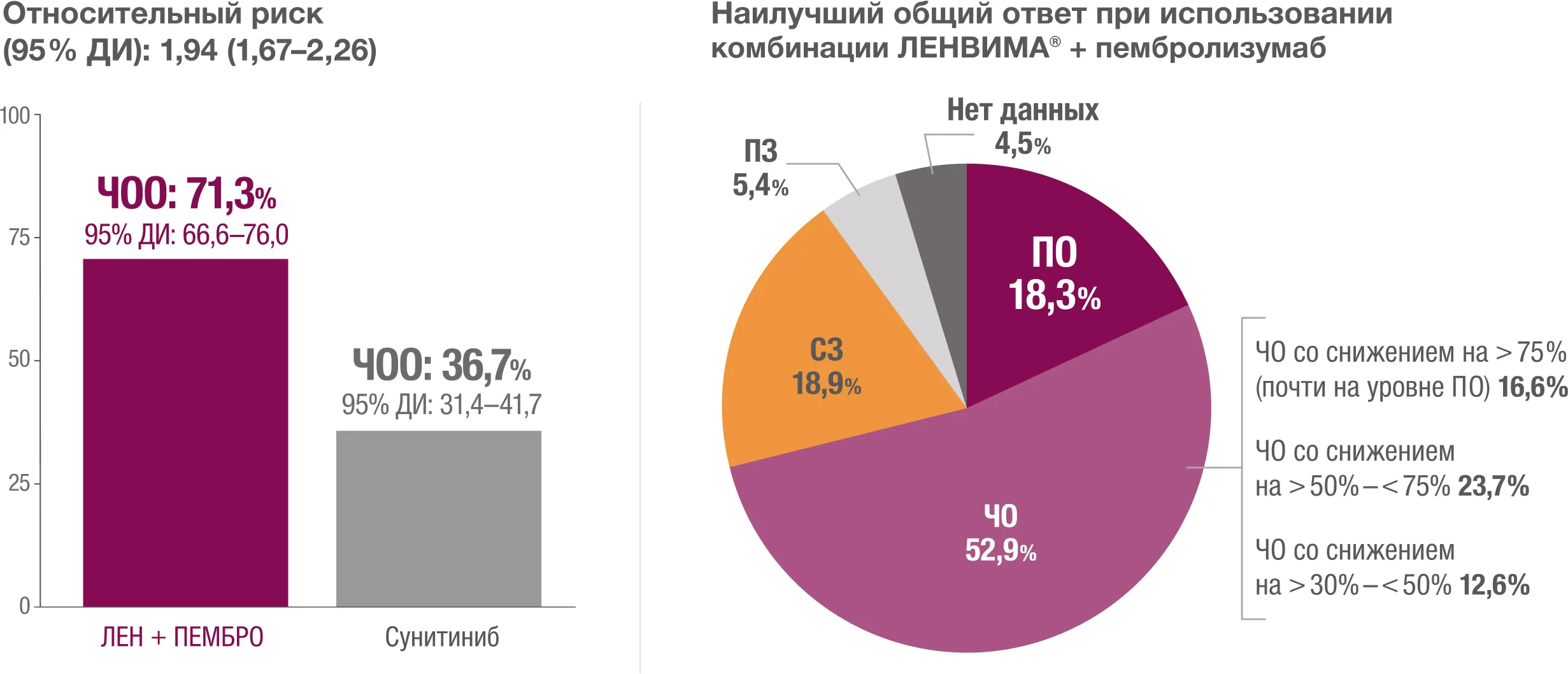
ПО — полный ответ; ЧО — частичный ответ; СЗ — стабилизация заболевания; ПЗ — прогрессирование заболевания.
* Частота объективного ответа определялась как доля пациентов, у которых наилучшим общим ответом был полный или частичный ответ по независимой оценке согласно критериям RECIST 1.1.
† Номинальное значение р.
ЛЕНВИМА® + пембролизумаб: 94,2 % пациентов, завершивших 2‑летнюю терапию пембролизумабом и продолжающих монотерапию ленватинибом, достигли 3‑летней ОВ3.
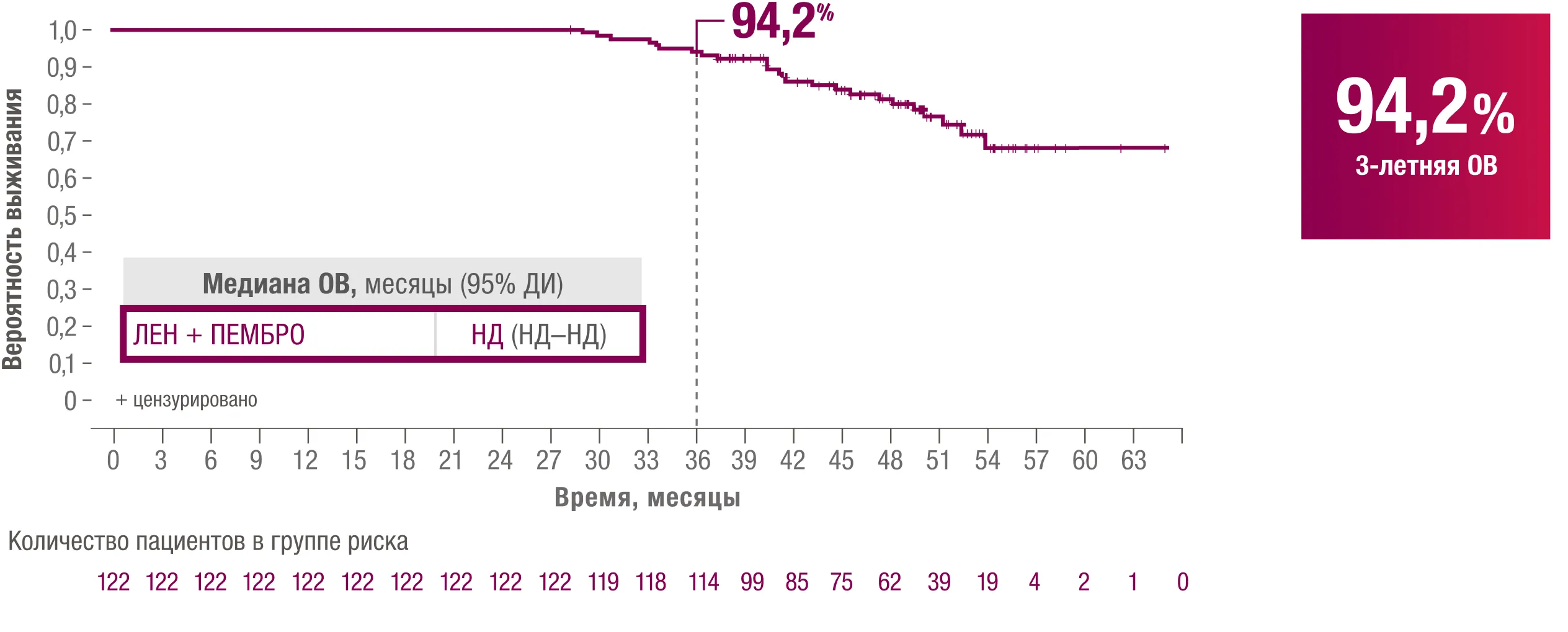
ОВ — общая выживаемость; НД — не достигнута; ДИ — доверительный интервал; ЛЕН — ленватиниб; ПЕМБРО — пембролизумаб.

Окончательный анализ ОВ (медиана наблюдения 4 года): через 2 года 80,4% пациентов были живы в группе ЛЕНВИМА® + пембролизумаб vs 69,6 % в группе сунитиниба3.
ОВ в апостериорном анализе при 49-месячном последующем наблюдении в исследовании CLEAR.
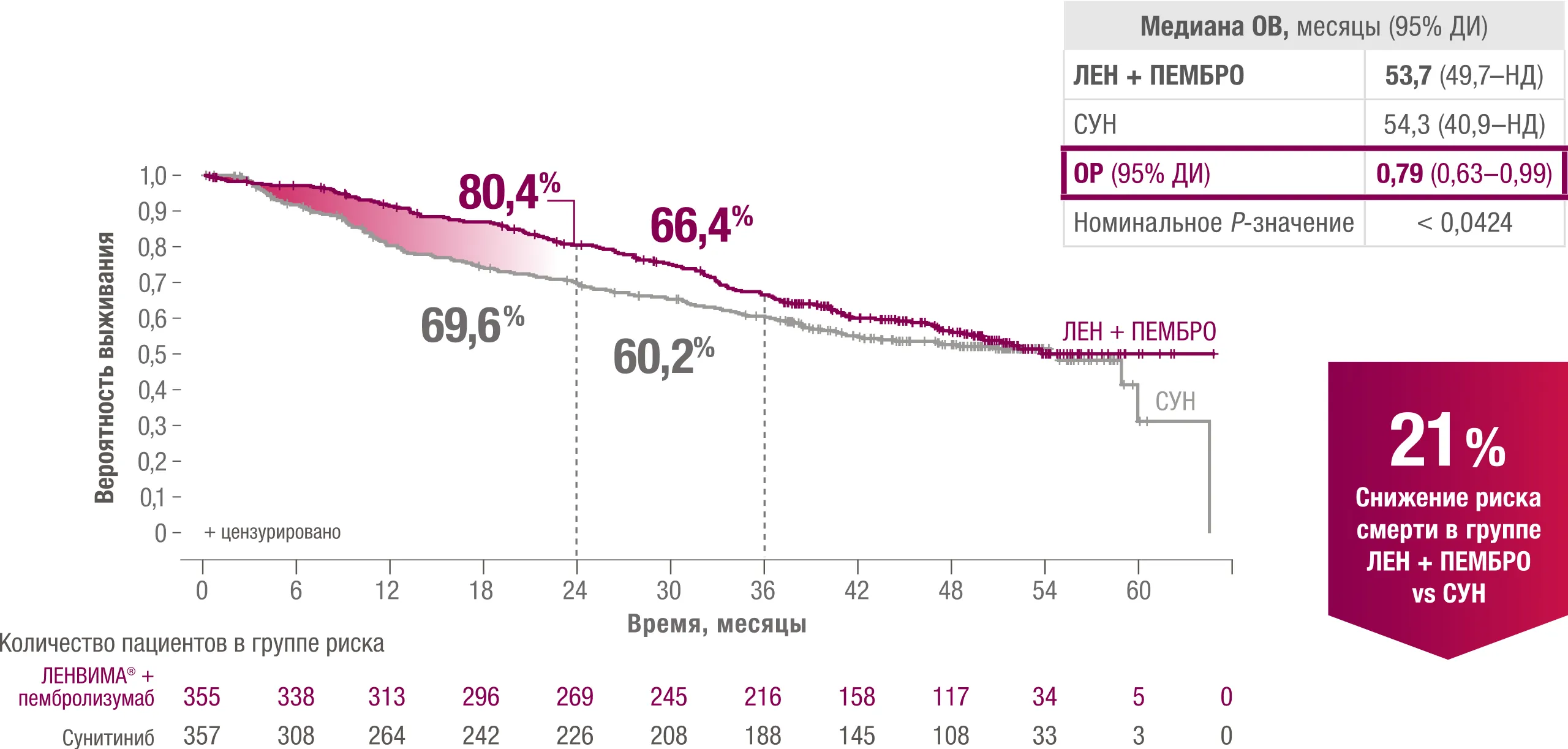
ЛЕН — ленватиниб; ПЕМБРО — пембролизумаб; СУН — сунитиниб; НД — не достигнуто; ОВ — общая выживаемость; ОР — отношение рисков.
Безопасность и переносимость
Профиль безопасности комбинации ЛЕНВИМА® + пембролизумаб соответствовал уже известному профилю безопасности каждого
из препаратов3
Исследование CLEAR: нежелательные явления, независимо от причины возникшие или усугубившиеся во время лечения по меньшей мере у 25% пациентов в любой из групп лечения3.
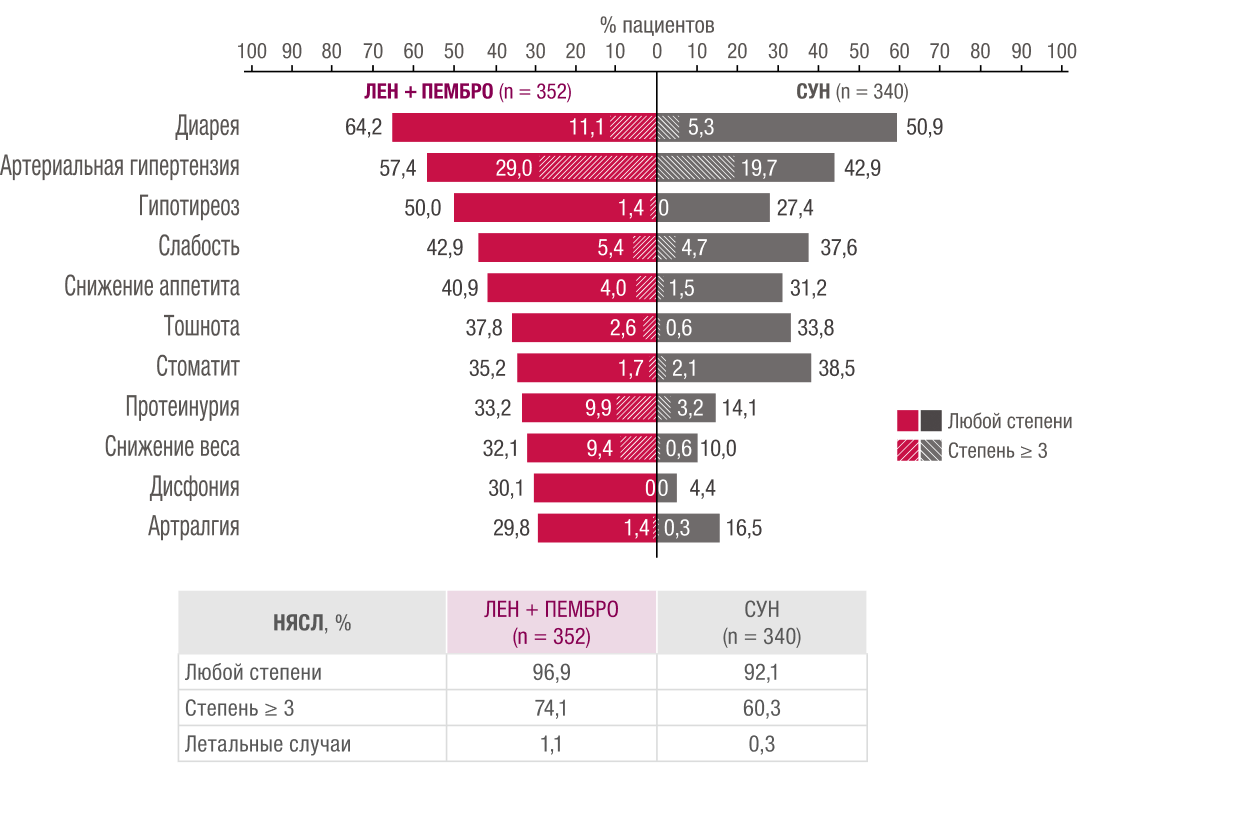
* Оценка безопасности выполнялась согласно проводимому лечению и заключалась в мониторинге и регистрации всех нежелательных и серьезных нежелательных явлений
с использованием Общих терминологических критериев для нежелательных явлений версии 4.03 в группах пациентов, получивших хотя бы одну дозу исследуемого препарата.
Явления перечислены в порядке убывания частоты
в группе ЛЕНВИМА® + пембролизумаб. Нежелательные явления кодировали согласно Медицинскому словарю регуляторной деятельности, версия 21.1 или выше,
с использованием термина низшего уровня, ближайшего к дословному термину.
† Гипотиреоз — это представляющее интерес нежелательное явление, связанное
с пембролизумабом. Информация об этих нежелательных явлениях как иммуноопосредованных не собиралась специально, чтобы сохранить заслепление.
‡ Из 15 пациентов группы ЛЕНВИМА® + пембролизумаб, у которых во время лечения развились нежелательные явления степени 5, у 11 была зарегистрирована смерть,
не связанная с прогрессированием заболевания (острая почечная недостаточность, неконтролируемая артериальная гипертензия, осложнения миастенического синдрома,
осложнения аутоиммунного гепатита, остановка сердца и причина смерти не указана у 1 пациента каждое; геморрагические явления у 2 пациентов и сепсис у 3 пациентов).
Среди 11 пациентов группы сунитиниба с развившимися во время лечения нежелательными явлениями степени 5 явления со смертельным исходом, не связанные с прогрессированием заболевания,
были зарегистрированы у 2 пациентов (дыхательная недостаточность и острая почечная недостаточность у 1 пациента и причина смерти не указана у 1 пациента).
Время до возникновения нежелательных явлений

Качество жизни

Режим дозирования
ЛЕНВИМА® + пембролизумаб: рекомендуемые дозы и режим применения при распространенном почечно-клеточном раке1.
Режим дозирования и способ применения препарата ЛЕНВИМА®1.
Один раз в сутки независимо от приема пищи*
Капсулы препарата ЛЕНВИМА® следует проглатывать целиком
Приготовить суспензию для приема внутрь с водой или яблочным соком
Примечание: см. способ приготовления ниже.
Приготовить суспензию для введения через зонд с водой
Примечание: см. способ приготовления ниже.
Изображение капсулы не соответствует фактическому размеру.
В случае пропуска дозы и невозможности ее принять в течение 12 часов следует пропустить эту дозу и принять следующую в обычное время1.
При применении препарата ЛЕНВИМА® в сочетании с пембролизумабом приостановку лечения, снижение дозы или прекращение приема препарата ЛЕНВИМА® следует предпринимать в соответствии с клинической ситуацией.
Необходимо мониторить и корректировать нежелательные реакции препарата ЛЕНВИМА® путем приостановки лечения, снижения дозы и прекращения терапии, в зависимости от клинической ситуации.
Терапию препаратом пембролизумаб следует приостановить или прекратить в соответствии с инструкцией по медицинскому применению лекарственного препарата4.
Для препарата пембролизумаб снижение дозы не рекомендуется4.
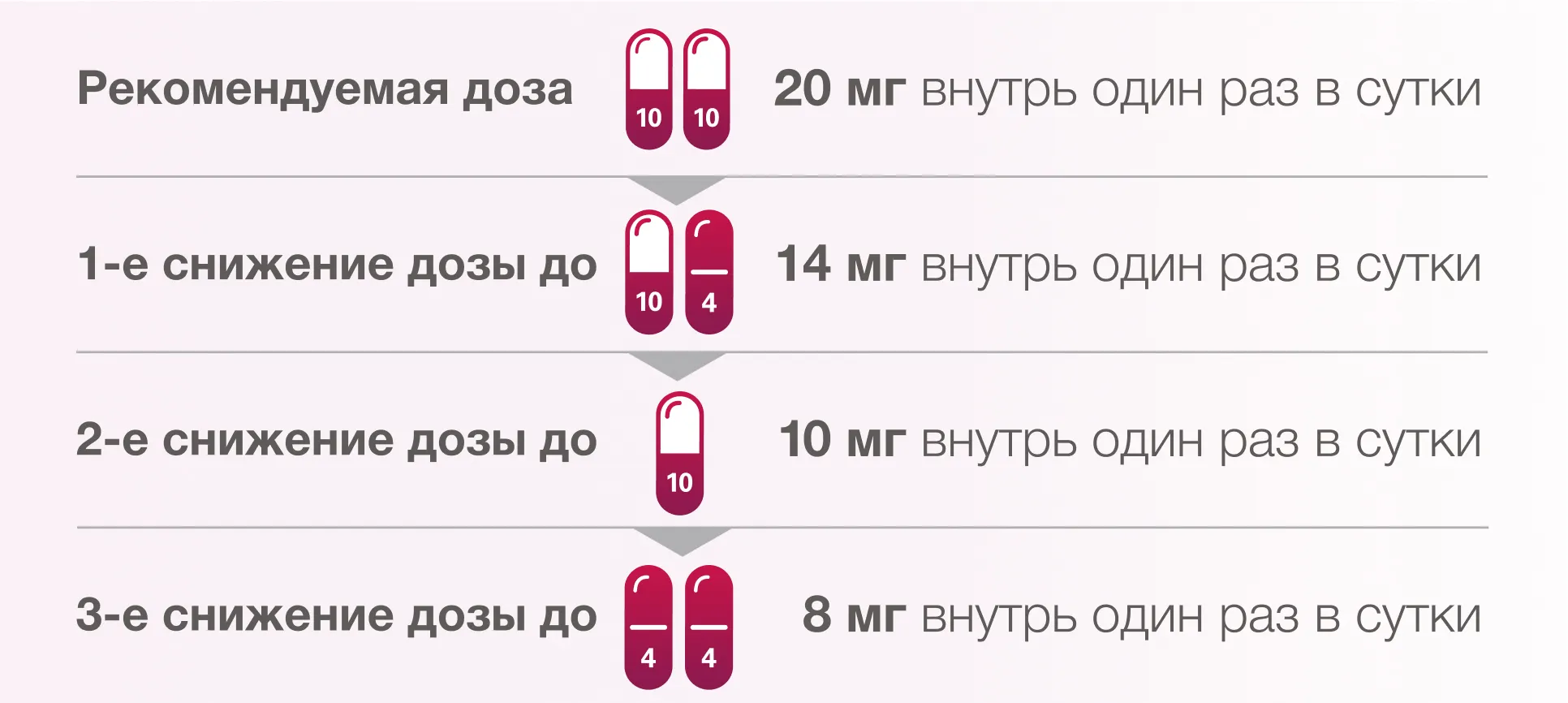
Рекомендации коррекции дозы препарата ЛЕНВИМА® при применении
в комбинации с пембролизумабом у пациентов с распространенным ПКР1.

Подробнее о препарате ЛЕНВИМА®
Последние новости и дополнительная информация
узнать больше
БОЛЕЕ ПОДРОБНАЯ ИНФОРМАЦИЯ О ПРЕПАРАТЕ ЛЕНВИМА®
Свяжитесь с представителем компании «Эйсай»
КонтактыДИ — доверительный интервал; ПО — полный ответ; ДО — длительность ответа; EORTC — Европейская организация по изучению и лечению злокачественных новообразований; EORTC QLQ-C30 — Групповой опросник оценки качества жизни Европейской организации по изучению и лечению злокачественных новообразований; EQ-5D-3L — Европейский опросник оценки качества жизни по 5 категориям, 3-уровневая версия; FGF — фактор роста фибробластов; FGFR — рецептор фактора роста фибробластов; FKSI-DRS — индекс симптомов рака почки; FLT — рецепторная тирозинкиназа, связанная с Fms; ОСЗ — общее состояние здоровья; ОР — отношение рисков; HRQoL — качество жизни, связанное со здоровьем; IFNγ — гамма-интерферон; IMDC — Международный консорциум по лечению метастатического ПКР; IRC — независимый комитет по оценке; IxRS — интерактивная система голосового/веб-ответа; KDR — рецептор со встроенным киназным доменом; мАТ — моноклональное антитело; МД — механизм действия; MSKCC — Мемориальный онкологический центр имени Слоуна — Кеттеринга; ЧОО — частота объективного ответа; ОВ — общая выживаемость; PD-1 — белок запрограммированной гибели клеток 1; PDGF — тромбоцитарный фактор роста; PD-L1 — лиганд рецептора запрограммированной гибели клеток 1; ВБП — выживаемость без прогрессирования; ЧО — частичный ответ; PRO — исходы, оцениваемые пациентами; КЖ — качество жизни; ПКР — почечно-клеточный рак; RECIST 1.1 — Критерии оценки ответа солидных опухолей вер. 1.1; RET — перестройка при трансфекции; РТК — рецепторная тирозинкиназа; ВАШ — визуальная аналоговая шкала; VEGF — фактор роста эндотелия сосудов; VEGFR — рецептор фактора роста эндотелия сосудов.
-
-
- 1. Общая характеристика лекарственного препарата (ОХЛП) ЛЕНВИМА® (ленватиниб), капсулы. РУ ЛП-№(001897)-(РГ-RU).
- 2. Kudo M. Cancer. 2018; 7: 1–19.
- 3. Motzer et al., JCO 42, 1222-1228(2024). DOI:10.1200/JCO.23.01569.
- 4. Инструкция по применению лекарственного препарата пембролизумаб. РУ ЛП-003972-050221.
-
