

ЛЕНВИМА® (ленватиниб)
Препарат Ленвима® показан к применению в монотерапии у взрослых пациентов с прогрессирующим местнораспространенным или метастатическим дифференцированным (папиллярным, фолликулярным, из клеток Гюртле) раком щитовидной железы, рефрактерным к терапии радиоактивным йодом1.

Механизм действия
Препарат ЛЕНВИМА® — ингибитор рецепторных тирозинкиназ (ИТК), зарегистрированный для лечения различных злокачественных новообразований, включая ДРЩЖ, рефрактерный к радиойодтерапии (РР ДРЩЖ)1.
Препарат ЛЕНВИМА® избирательно ингибирует активность нескольких рецепторных тирозинкиназ (РТК), связанных с проангиогенным и онкогенным путями, включая рецепторы фактора роста эндотелия сосудов (VEGF) VEGFR1, VEGFR2 и VEGFR3, фактора роста фибробластов (FGFR1, 2, 3 и 4), альфа-рецептор тромбоцитарного фактора роста (PDGFRα), а также тирозинкиназные рецепторы KIT и RET1-4.
Помимо подавления опухолевого роста, препарат ЛЕНВИМА® ингибирует ангиогенез и лимфоангиогенез, а также устраняет резистентность
к антиангиогенным препаратам4.
Механизм действия препарата ЛЕНВИМА®2
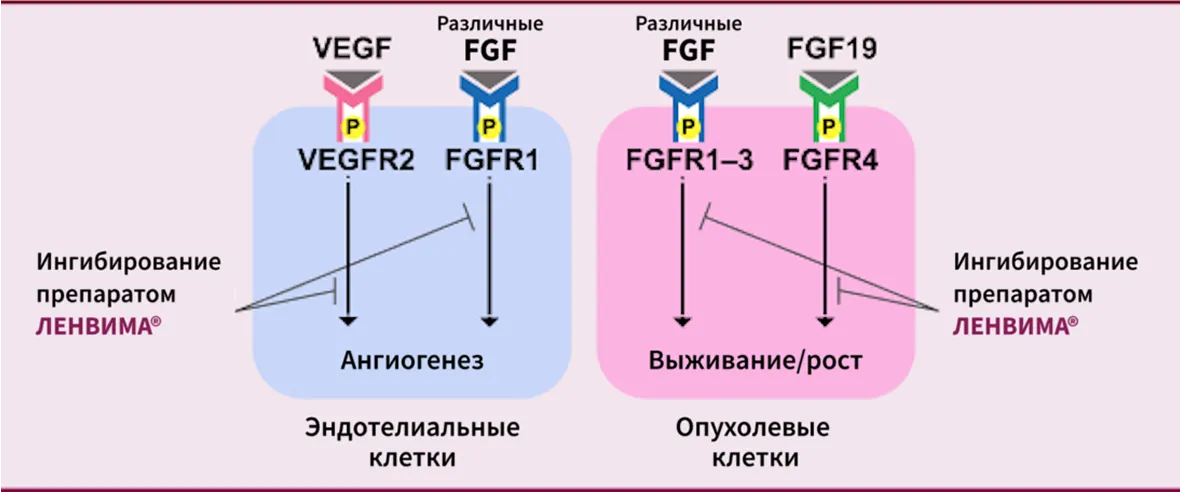
По материалам Kudo M. Liver Cancer. 2018; 7(1): 1–19.
Исследование SELECT
ИССЛЕДОВАНИЕ SELECT — МЕЖДУНАРОДНОЕ МНОГОЦЕНТРОВОЕ РАНДОМИЗИРОВАННОЕ
ДВОЙНОЕ СЛЕПОЕ ПЛАЦЕБО-КОНТРОЛИРУЕМОЕ ИССЛЕДОВАНИЕ ФАЗЫ III5.

Эффективность
В исследовании SELECT оценивали влияние препарата ЛЕНВИМА® на выживаемость без прогрессирования (ВБП)*, 5.
На момент проведения основного анализа ВБП было зарегистрировано 220 событий первичной конечной точки: 111/261 (42,5%) в группе препарата ЛЕНВИМА®
(42,5%; 93 случая прогрессирования, 14 случаев смертей) и 113/131 (86,3%) в группе плацебо (109 случаев прогрессирования, 4 случая смерти)5.
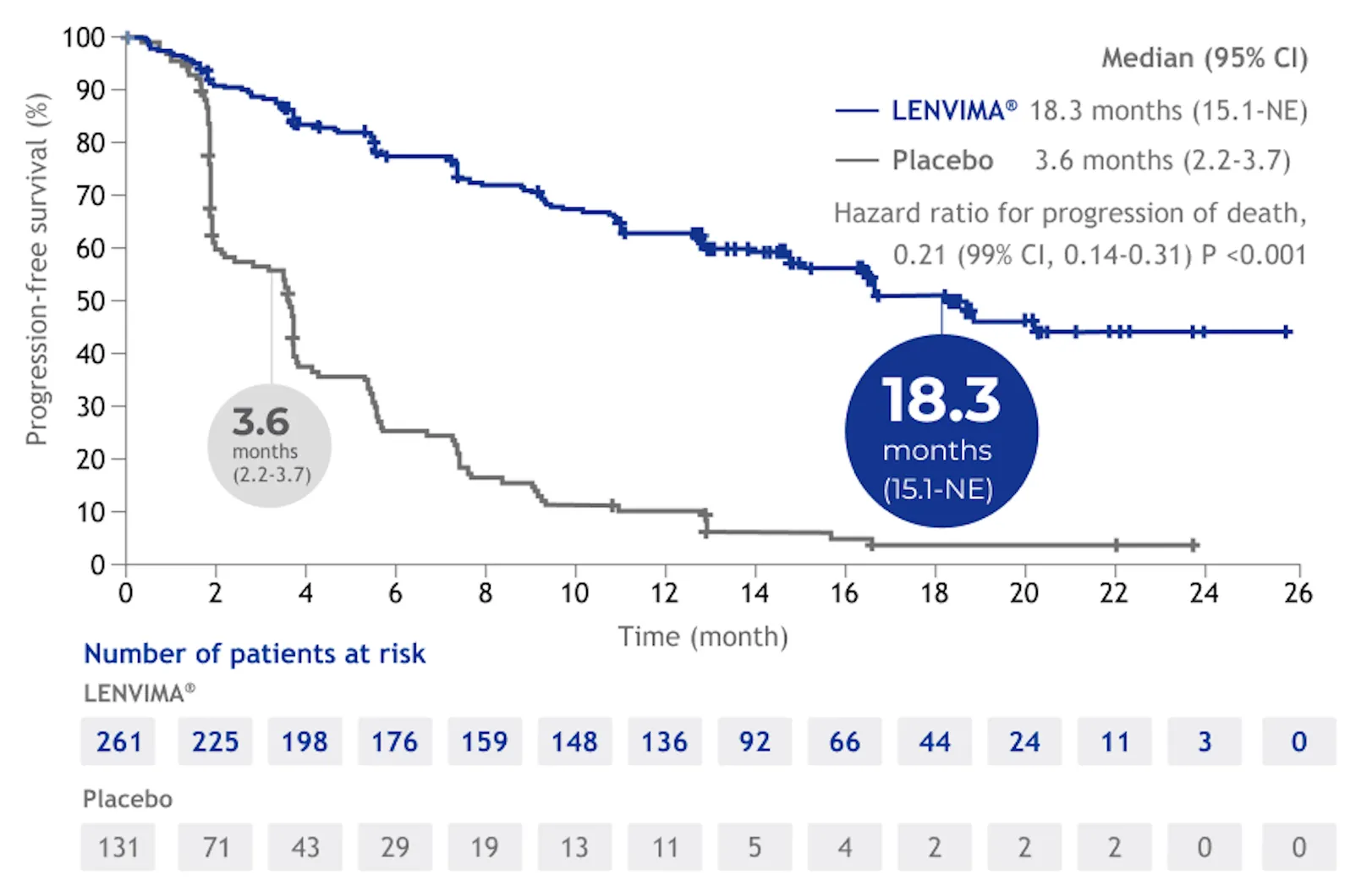
ПРЕПАРАТ ЛЕНВИМА® ЗНАЧИМО УВЕЛИЧИВАЛ ВБП ПО СРАВНЕНИЮ С ПЛАЦЕБО
Снижая относительный риск прогрессирования заболевания или смерти
на 79%5
* Ответ опухоли на лечение оценивался на основании критериев RECIST версии 1.1 и подтверждался независимым комитетом централизованной радиологической оценки. Ответ опухоли на лечение рассчитывали как максимальное процентное изменение суммы диаметров таргетных очагов относительно исходного уровня.

В ИССЛЕДОВАНИИ SELECT ОБЪЕКТИВНЫЙ ОТВЕТ НА ТЕРАПИЮ ПРЕПАРАТОМ ЛЕНВИМА®
БЫЛ ДОСТИГНУТ В 63%5
У пациентов, получавших препарат ЛЕНВИМА®, наблюдалось значимое увеличение частоты объективного ответа (ЧОО)* по сравнению с пациентами, получавшими плацебо: 64,8% vs 1,5%, [ОШ: 28,87; 95% ДИ: 12,46–66,86; р < 0,001]5.
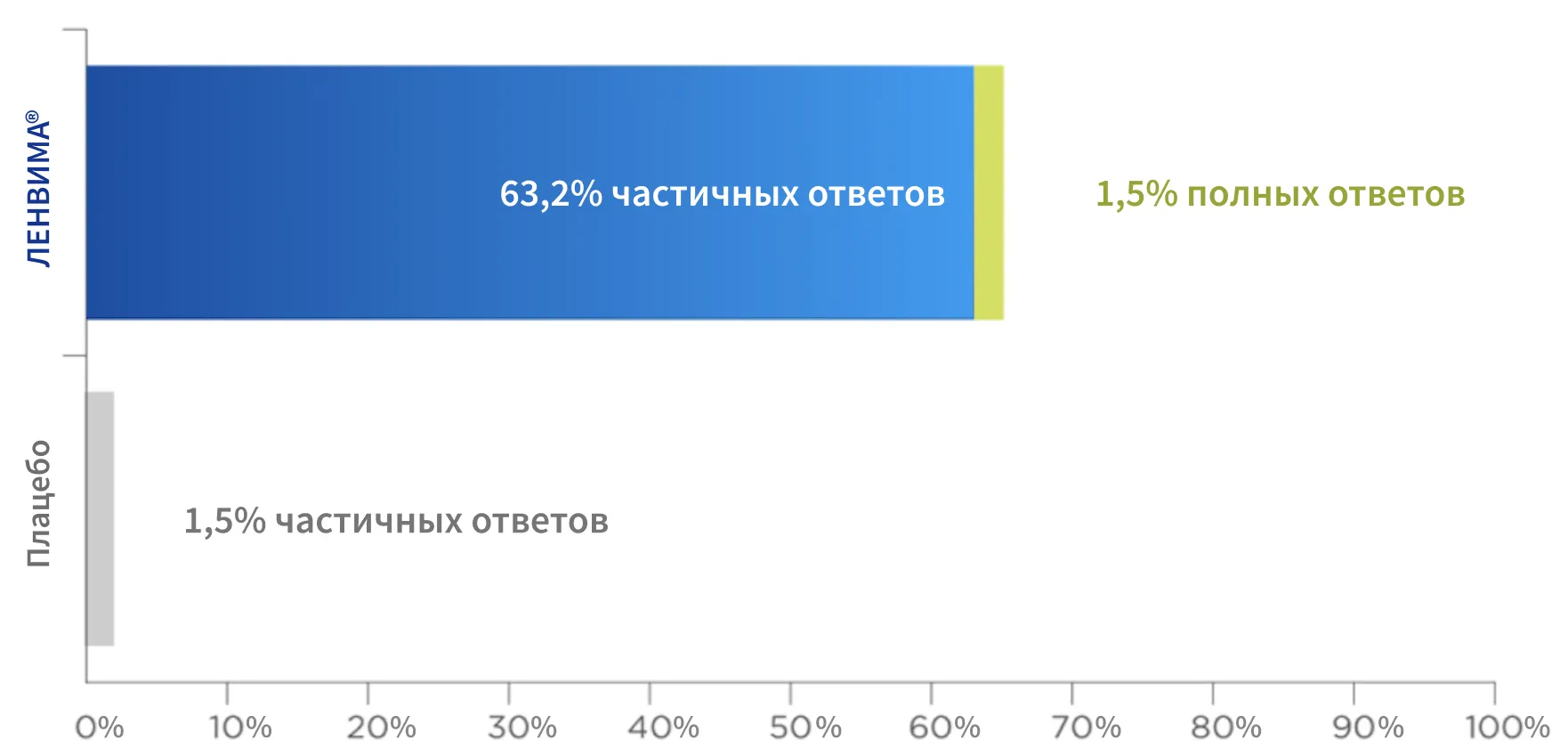
* Ответ опухоли на лечение оценивался на основании критериев RECIST версии 1.1 и подтверждался независимым комитетом централизованной радиологической оценки. Ответ опухоли на лечение рассчитывали как максимальное процентное изменение суммы диаметров таргетных очагов относительно исходного уровня.
ИССЛЕДОВАНИЕ SELECT: ОБЩАЯ ВЫЖИВАЕМОСТЬ (ОВ) ОЦЕНИВАЛАСЬ КАК ВТОРИЧНАЯ КОНЕЧНАЯ ТОЧКА5
Общая выживаемость В ПОПУЛЯЦИИ ВСЕХ РАНДОМИЗИРОВАННЫХ ПАЦИЕНТОВ (ITT)5, 6
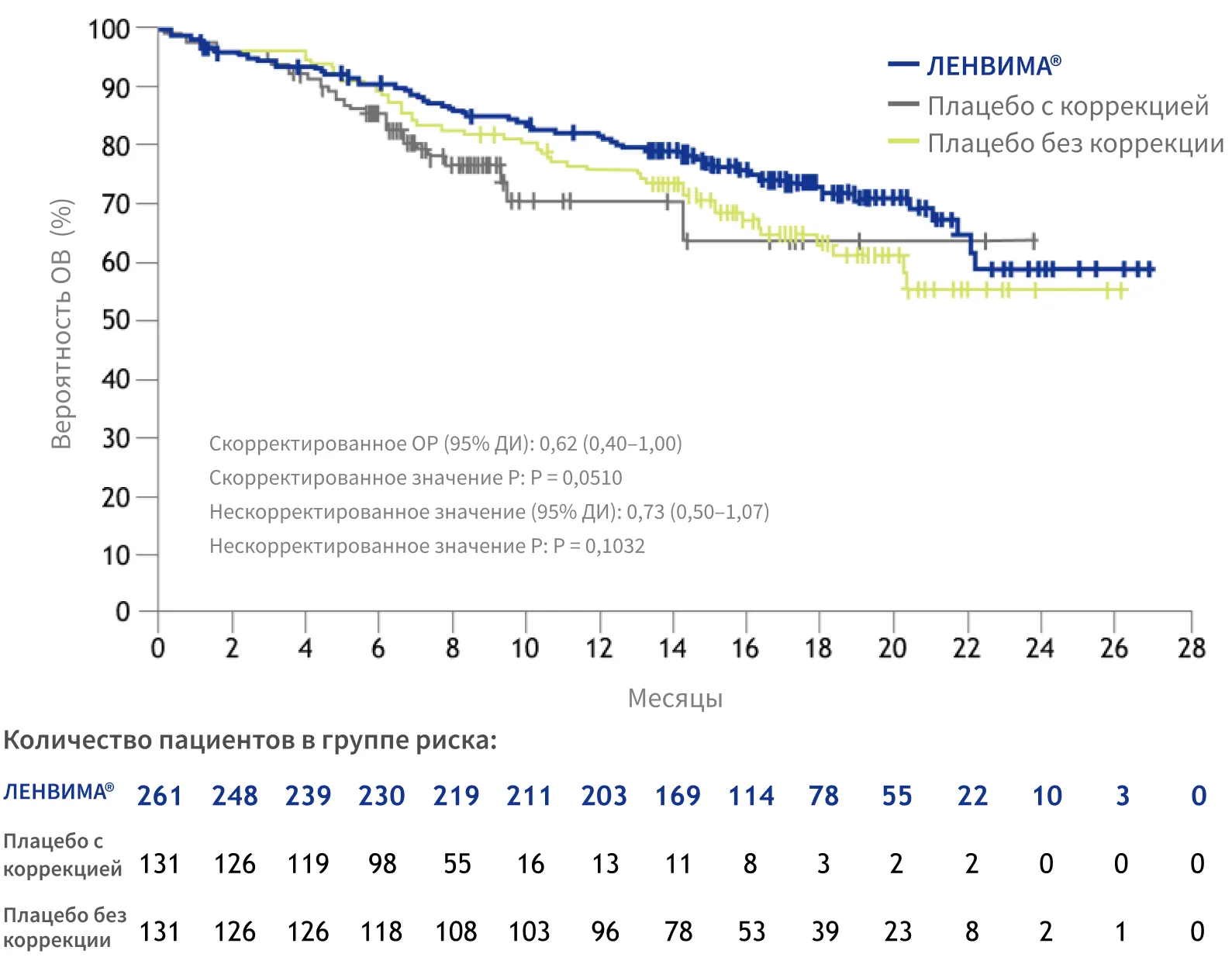
83%
пациентов перешли из группы плацебо на терапию препаратом ЛЕНВИМА®, что могло исказить результаты анализа ОВ5
ОВ также оценивали в заранее определенном анализе в подгруппах со стратификацией по возрасту ≤ 65 или > 65 лет: продемонстрировано значимое увеличение ОВ у пожилых пациентов, получавших препарат ЛЕНВИМА®, по сравнению с пациентами, получавшими плацебо (ОР, 0,53 [95% ДИ: 0,31–0,91; р = 0,020])7.
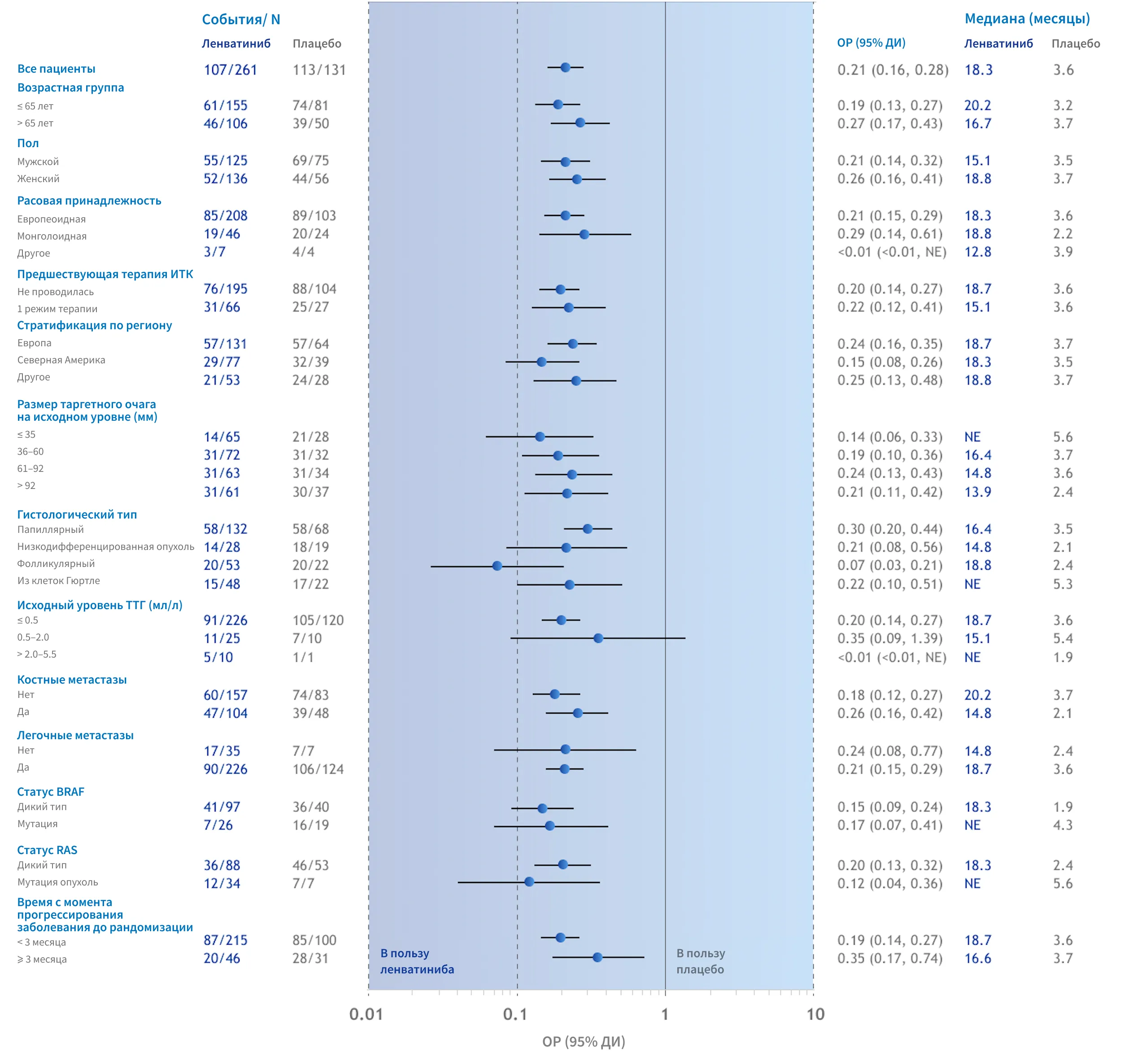
УВЕЛИЧЕНИЕ выживаемости без прогрессирования (ВБП) ПРИ ПРИМЕНЕНИИ ПРЕПАРАТА ЛЕНВИМА® НАБЛЮДАЛОСЬ ВО ВСЕХ ПОДГРУППАХ пациентов6
Увеличение ВБП при применении препарата ЛЕНВИМА® наблюдалось во всех заранее определенных подгруппах исследования SELECT, включая подгруппы, выделенные на основании возраста, пола, расовой принадлежности, предшествующей терапии и гистологических данных6.
В апостериорном анализе данных исследования SELECT при применении препарата ЛЕНВИМА® наблюдался устойчивый ответ с медианой максимального процентного изменения размера опухоли −42,9% у всех пациентов, получавших данный препарат8.
НЕПРЕРЫВНое УМЕНЬШение РАЗМЕРов ОПУХОЛИ В ДИНАМИКЕ у пациентов, получавших препарат ЛЕНВИМА®8
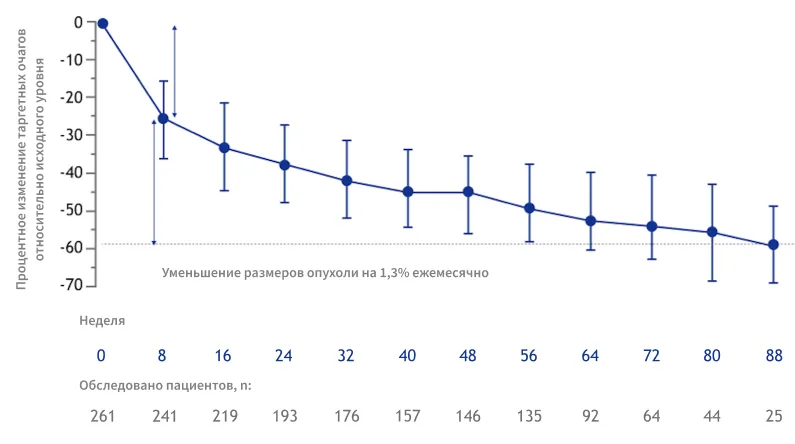
По результатам анализа данных исследования SELECT отмечено:
начальное среднее уменьшение размеров опухоли на 25,2% к неделе 8 у пациентов, получавших препарат ЛЕНВИМА®, а также последующее непрерывное уменьшение размеров опухоли на 13% ежемесячно8.
Этот апостериорный анализ не обладал достаточной мощностью для определения различий. Клинически значимые выводы из апостериорного анализа сделать невозможно.
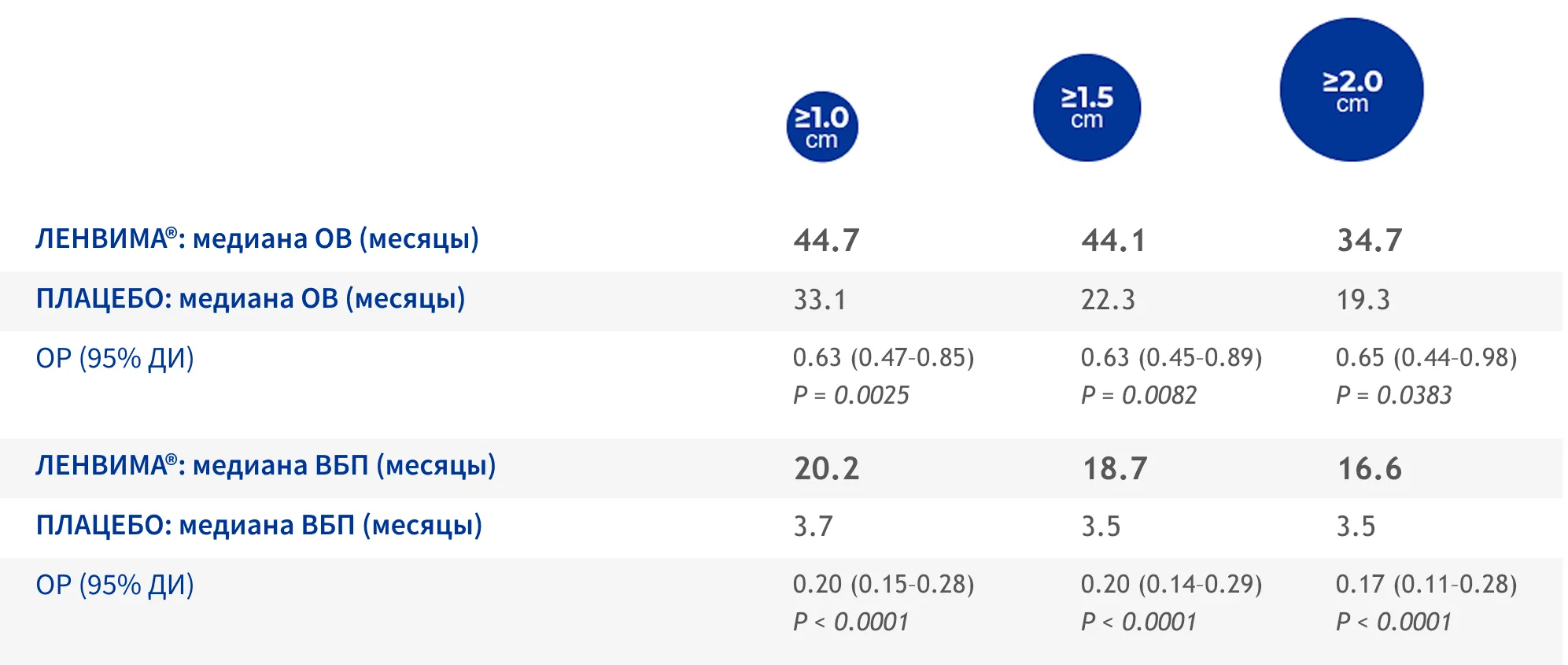
В АПОСТЕРИОРНОМ АНАЛИЗЕ ДАННЫХ ИССЛЕДОВАНИЯ SELECT У ПАЦИЕНТОВ С МЕНЬШИМИ
размерами МЕТАСТАЗОВ В ЛЕГКИХ НАБЛЮДАЛАСЬ БОЛЕЕ ВЫСОКАЯ ВЫЖИВАЕМОСТЬ9
У пациентов с меньшими размерами метастатических очагов в легких медианы ОВ и ВБП были выше по сравнению с пациентами с более крупными очагами9.
В ИССЛЕДОВАНИИ SELECT
89,3%
пациентов имели метастазы в легких, из них
в 78,1%
случаев метастазы имели диаметр ≥ 1,0 см5, 9
У ПАЦИЕНТОВ С МЕТАСТАЗАМИ В ЛЕГКИХ РАЗМЕРОМ БОЛЕЕ 1 СМ ЦЕЛЕСООБРАЗНО НАЧИНАТЬ ТЕРАПИЮ ПРЕПАРАТОМ ЛЕНВИМА® РАНЬШЕ, ДО ПРОГРЕССИРОВАНИЯ ЗАБОЛЕВАНИЯ
Этот апостериорный анализ не обладал достаточной мощностью для определения различий. Клинически значимые выводы из апостериорного анализа сделать невозможно.

SELECT, подгрупповой анализ:
увеличение ОВ пациентов с ECOG = 0 vs ECOG = 19
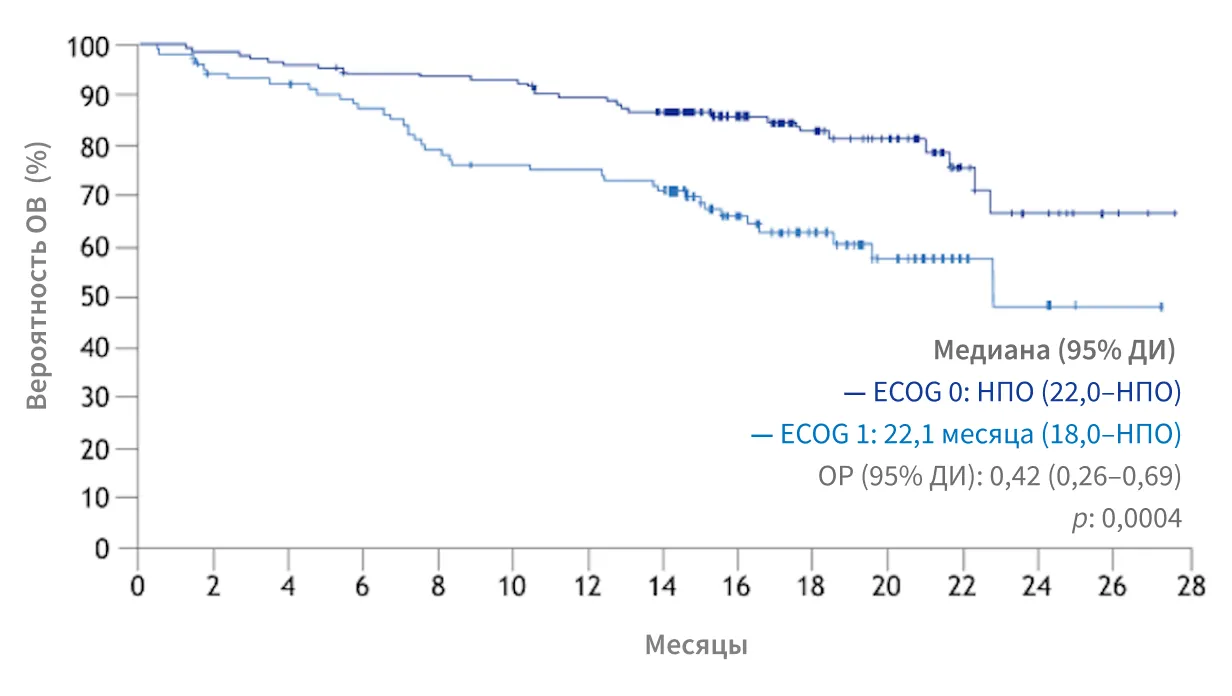
Медиана ОВ у пациентов с ЕCOG 0 не подлежала оценке, у пациентов с ECOG 1 составила 22,1 месяца (ОР: 0,42, 95% ДИ: 0,26–0,69, р = 0,0004)
SELECT, подгрупповой анализ:
увеличение ВБП пациентов с ECOG = 0 vs ECOG = 110
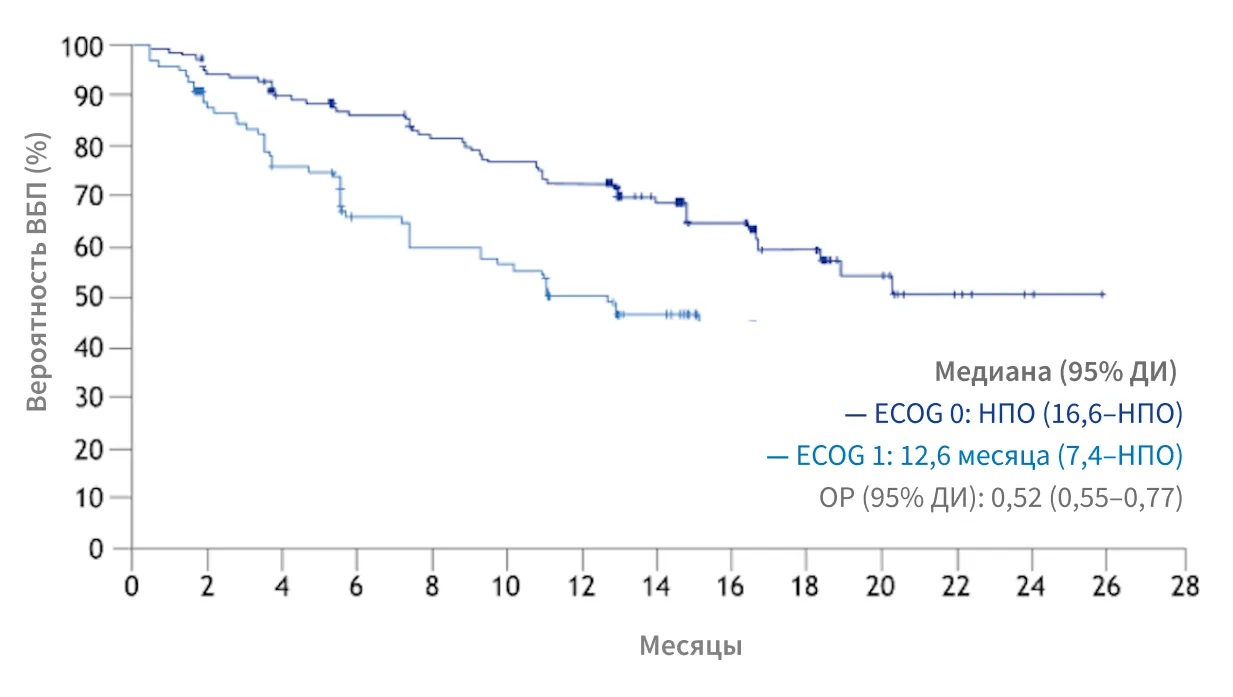
Медиана ВБП у пациентов с ECOG 0 не подлежала оценке, у пациентов с ECOG 1 составила 12,6 месяца (ОР: 0,52, 95% ДИ: 0,35–0,77, р = 0,001)
Этот апостериорный анализ не обладал достаточной мощностью для определения различий. Клинически значимые выводы из апостериорного анализа сделать невозможно.
РЕЗУЛЬТАТЫ ПОДГРУППОВОГО АНАЛИЗА СВИДЕТЕЛЬСТВУЮТ О ЦЕЛЕСООБРАЗНОСТИ НАЧИНАТЬ ТЕРАПИЮ ПРЕПАРАТОМ ЛЕНВИМА® РАНЬШЕ, У ПАЦИЕНТОВ С ECOG = 0, ДО УХУДШЕНИЯ ОБЩЕГО СОСТОЯНИЯ, ДЛЯ ДОСТИЖЕНИЯ МАКСИМАЛЬНОГО ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА10
В ИССЛЕДОВАНИИ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ У ПАЦИЕНТОВ, ПОЛУЧАВШИХ ПРЕПАРАТ ЛЕНВИМА® В ПЕРВОЙ ЛИНИИ, И У ПАЦИЕНТОВ В ИССЛЕДОВАНИИ SELECT ОТВЕТЫ НА ЛЕЧЕНИЕ БЫЛИ СХОЖИ11.
По данным ретроспективного многоцентрового исследования (США): частота объективных ответов (ЧОО) у пациентов, получавших препарат ЛЕНВИМА® в условиях реальной клинической практики, составила 64,8%, включая 8,5% полных ответов и 56,3% частичных ответов (когорта пациентов, продолжавших лечение препаратом ЛЕНВИМА® на дату окончания сбора данных†). В когорте пациентов, которые на момент сбора данных прекратили терапию первой линии препаратом ЛЕНВИМА® по причине прогрессирования, переносимости или выбора пациента и начали получать вторую линию терапии, ЧОО составила 53,6%, включая ПО = 1,7% и ЧО = 51,9%11.
* ЧОО определяется как сумма ПО и ЧО.
† Дата окончания сбора данных: 17 октября 2018 г11.
Целью данного исследования была оценка эффективности терапии у пациентов с РР ДРЩЖ в реальной клинической практике, получавших препарат ЛЕНВИМА® в первой линии лечения.
Кроме этого, в качестве вторичной цели оценивалась эффективность последовательного назначения различных лекарственных режимов во второй линии после ленватиниба.
Пациенты должны были начать терапию второй линии к дате окончания сбора данных — это могло привести к систематической ошибке занижения вследствие преимущественного
отбора пациентов с более поздними стадиями заболевания.
ОБОСНОВАННОСТЬ ИСПОЛЬЗОВАНИЯ ЗАРЕГИСТРИРОВАННОЙ СТАРТОВОЙ ДОЗЫ ПРЕПАРАТА ЛЕНВИМА® 24 МГ/СУТКИ подтверждена в рамках клинического исследования12.
Исследование 211 представляло собой многоцентровое двойное слепое исследование фазы II, в котором 152 пациента с РР ДРЩЖ были рандомизированы на 2 группы: для применения препарата ЛЕНВИМА® в дозе 18 мг/сут или в зарегистрированной дозе 24 мг/сут. Первичными конечными точками были ЧОО на неделе 24 и частота нежелательных явлений, возникших во время лечения (НЯВЛ), степени ≥ 3 в первые 24 недели после рандомизации.
- На неделе 24 ЧОО составила 40,3% у пациентов, получавших препарат ЛЕНВИМА® в дозе 18 мг/сут, и 57,3% у пациентов, получавших препарат ЛЕНВИМА® в дозе 24 мг/сут (ОШ: 0,50 [95% ДИ: 0,26–0,95])12
- Для дозы 18 мг/сут не удалось подтвердить не меньшую эффективность по сравнению с дозой 24 мг/сут12
- Частота НЯВЛ степени ≥ 3 была схожей в обеих группах лечения12
Исследование 211 включало незарегистрированный режим дозирования (18 мг), который вошел в этот раздел в качестве контекста.

НА ОСНОВАНИИ УСТАНОВЛЕННОЙ ЭФФЕКТИВНОСТИ ПРЕПАРАТ ЛЕНВИМА® ВКЛЮЧЕН В РЕКОМЕНДАЦИИ NCCN13.
-
ЛЕНВИМА® — предпочтительный вариант* терапии первой линии для пациентов с РР ДРЩЖ при наличии клинического прогрессирования или симптомов*.
* Предпочтительными являются вмешательства с доказанной высокой эффективностью, безопасностью и доступностью.
-
Рекомендации по применению препарата ЛЕНВИМА®, основанные на результатах исследования SELECT, относятся к категории 1**.
** Рекомендации категории 1 основаны на фактических данных высокого уровня доказательности, существует единый консенсус NCCN о целесообразности вмешательства.
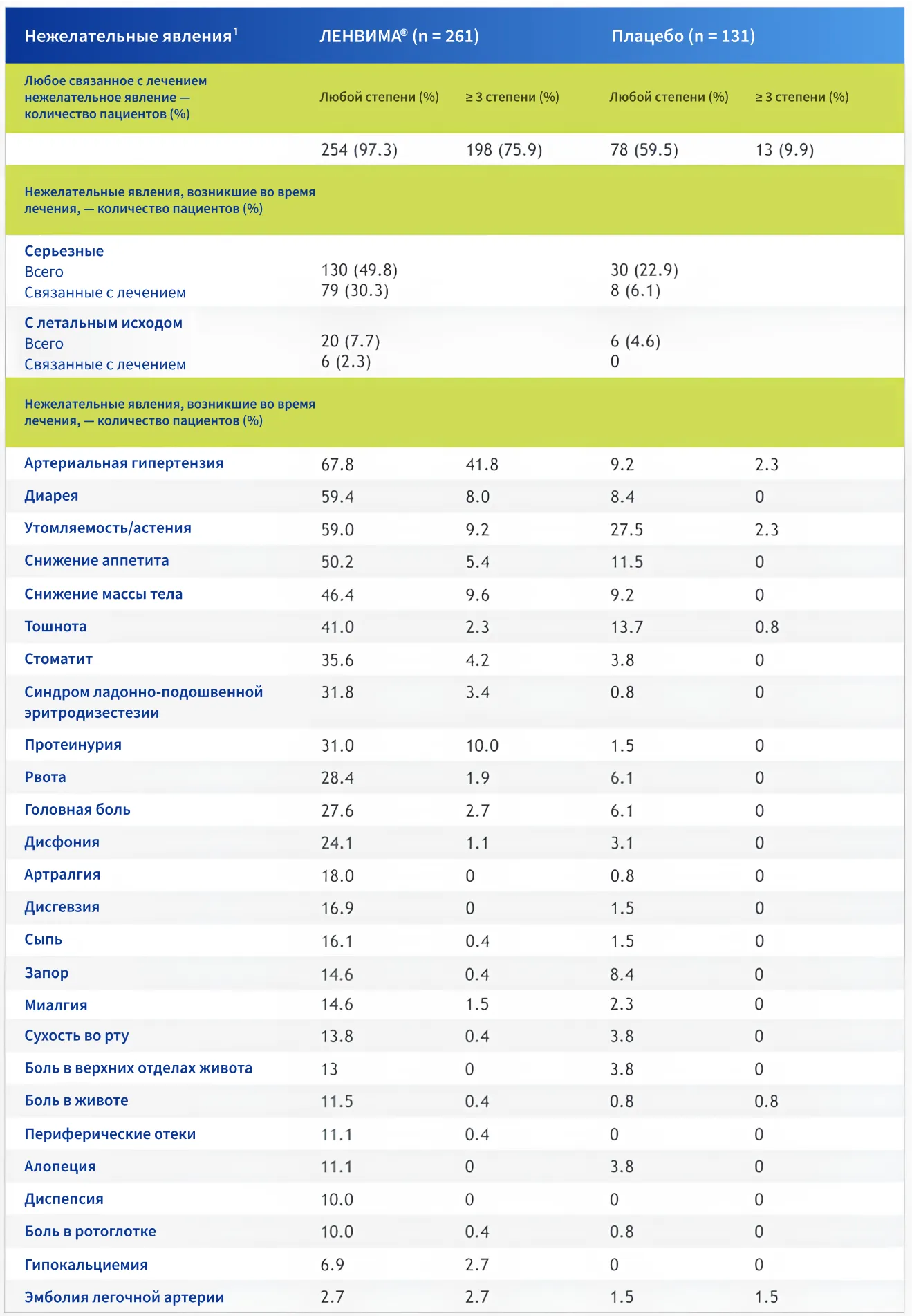
Безопасность и переносимость
В исследовании SELECT нежелательные явления (НЯ), связанные с препаратом ЛЕНВИМА®, были предсказуемыми и управляемыми5.
В таблице представлены подробные данные о профиле безопасности, полученные в исследовании SELECT
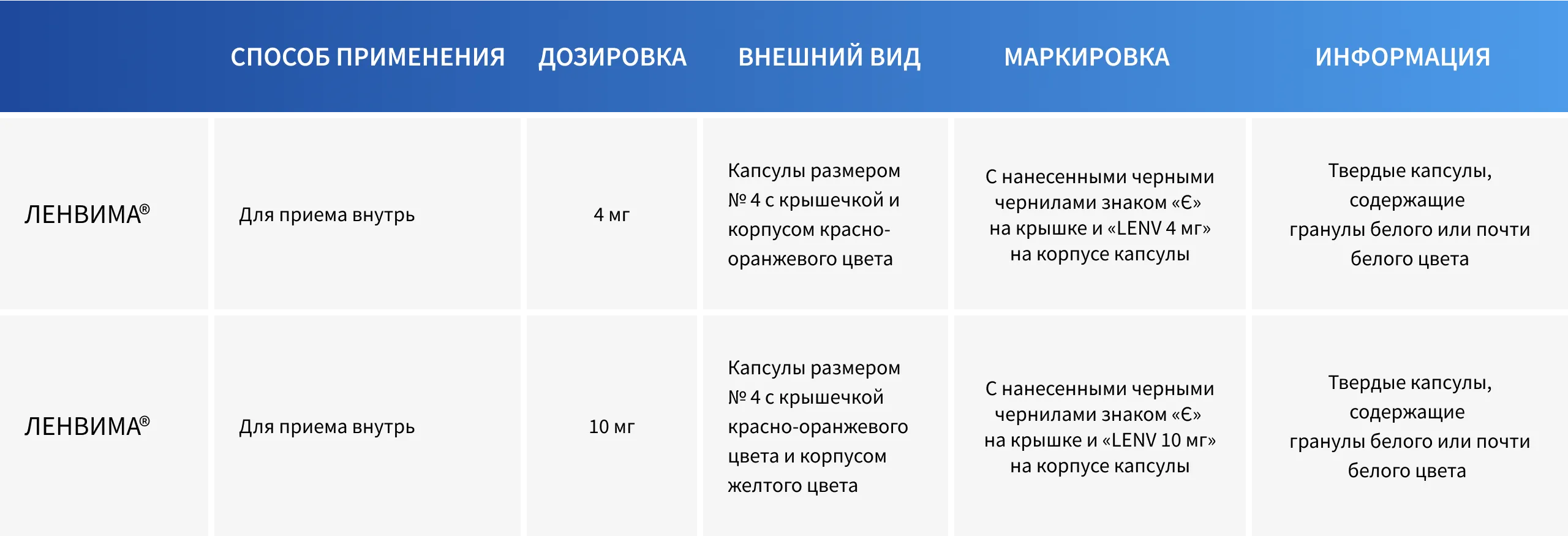
ЛЕНВИМА®: режим дозирования
Рекомендованная доза препарата ЛЕНВИМА® составляет 24 мг один раз в сутки1.
Полную информацию о режиме дозирования см. в Общей характеристике лекарственного препарата (ОХЛП)1.
ИНФОРМАЦИЯ по дозировкам препарата ЛЕНВИМА®1.
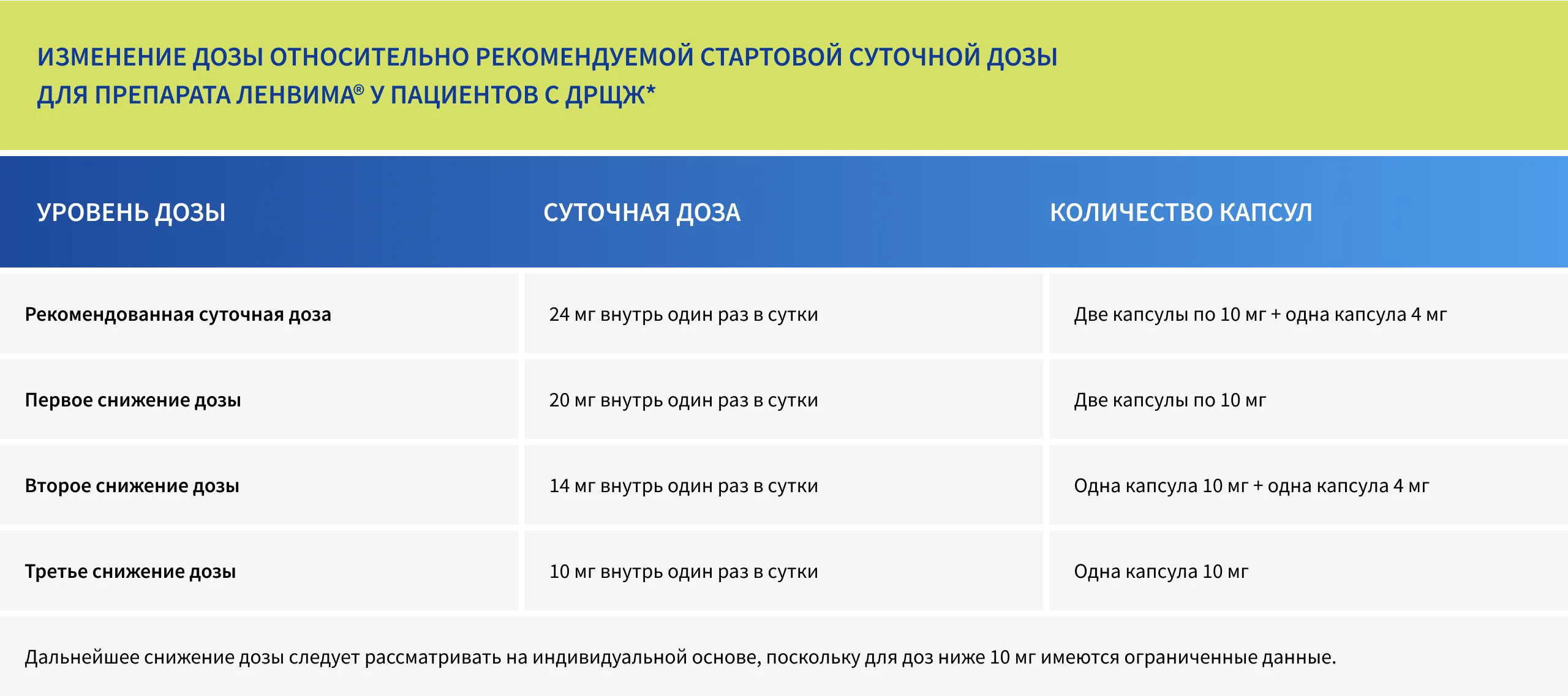
Снижение дозы препарата ЛЕНВИМА® обеспечивает возможность продолжения эффективного лечения в случае развития выраженных нежелательных явлений. Редукция дозы препарата ЛЕНВИМА® потребовалась 68% пациентам в исследовании SELECT5.
РЕКОМЕНДАЦИИ ПО временной ПРИОСТАНОВКЕ ЛЕЧЕНИЯ И СНИЖЕНИЮ ДОЗЫ препарата ЛЕНВИМА® ПРЕДСТАВЛЕНЫ В ТАБЛИЦЕ НИЖЕ1
БОЛЕЕ ПОДРОБНАЯ ИНФОРМАЦИЯ О ПРЕПАРАТЕ ЛЕНВИМА®
Свяжитесь с представителем компании «Эйсай»

НЯ — нежелательное явление; ДИ — доверительный интервал; ПО — полный ответ; ДРЩЖ — дифференцированный рак щитовидной железы; ОС по шкале ECOG — общее состояние по шкале Восточной объединенной онкологической группы; ESMO — Европейское общество медицинской онкологии; FGF — фактор роста фибробластов; ОР — отношение рисков; ITT — популяция всех рандомизированных пациентов; мОВ — медиана общей выживаемости; мВБП — медиана выживаемости без прогрессирования; NCCN — Национальная всеобщая онкологическая сеть; НПО — не подлежит оценке; ОШ — отношение шансов; ЧОО — частота общего ответа; ОВ — общая выживаемость; ВБП — выживаемость без прогрессирования; ЧО — частичный ответ; РЙ — радиойодтерапия; РР — рефрактерный к радиойодтерапии; РР ДРЩЖ — рефрактерный к радиойодтерапии дифференцированный рак щитовидной железы; RECIST — критерии оценки ответа солидных опухолей; RET — перестройка при трансфекции; РТК — рецепторная тирозинкиназа; НЯВЛ — нежелательное явление, возникшее во время лечения; ИТК — ингибитор тирозинкиназы; VEGF — фактор роста эндотелия сосудов.
-
-
- 1. Общая характеристика лекарственного препарата (ОХЛП) Ленвима® (ленватиниб), капсулы. РУ ЛП-№(001897)-(РГ-RU).
- 2. Kudo M. Liver Cancer. 2018; 7(1): 1–19.
- 3. Okamoto K., et al. ACS Med Chem Lett. 2015; 6: 89–94.
- 4. Matsuki M., et al. Cancer Med. 2018; 7: 2641–2653.
- 5. Schlumberger M., et al. N Engl J Med. 2015; 372(7): 621–630.
- 6. Schlumberger M., et al. N Engl J Med. 2015; 372(7): 621–630 (supplementary appendix).
- 7. Brose M. S., et al. Lancet. 2014; 384(9940): 319–328.
- 8. Robinson B., et al. J Clin Endocrinol Metab. 2016; 101(11): 4103–4109.
- 9. Tahara M., et al. Eur J Cancer. 2021; 147: 51–57.
- 10. Taylor M. H., et al. Thyroid. 2021; 31: 1226–1234.
- 11. Kish J. K., et al. Adv Ther. 2020; 37: 2841–2852.
- 12. Brose M. E., et al. J Clin Endocrinol Metab. 2022; 107(3): 776–787.
- 13. NCCN. Thyroid carcinoma. Version 3. 2022. https://www.nccn.org/professionals/physician_gls/pdf/thyroid.pdf (Accessed May 2023).
-
